Cdc42 Protein (GST Tagged) - Zytoskelett, Inc
Produkt-Anwendungen sind
- Cdc42 GEF Bindungsstudien
- Die Hemmung von Cdc42 GEFs in vitro
- Die Hemmung von Cdc42 in vivo durch Mikroinjektions
Material
Die dominant negative Form des Cdc42 Protein (G25K-Isoform) enthält ein Threonin an Asparagin-Substitution an Rest 17. Der gemeinsame Name für diese Mutante Cdc42 (T17N) (oder N17Cdc42). Die Asparagin Substitution abschafft die Affinität des Proteins für GTP und reduziert seine Affinität für das BIP. Daher ist die Cdc42 (T17N) immer entweder in einem nucletiode freien Zustand oder in ihrem inaktiven, GDP-gebundenen Zustand. Aus diesem Grunde, bindet es stark an Cdc42 GEFs und blockiert es Wildtyp-Cdc42 aus durch diesen GEFs aktiviert wird.
Dominant negative Form des menschlichen Cdc42 Proteins wurde in einem bakteriellen System exprimiert wird, und ist als ein GST-tagged-Fusionsprotein zur Verfügung. Das rekombinante Protein ist 50 kDa, bestehend aus dem Cdc42 Protein (22 kDa) und einen 28 kDa GST-Tag. Der Tag ist am Aminoende des Proteins. Das Protein wird als lyophilisiertes Pulver zugeführt wird. Wenn es in destilliertem Wasser auf 1 mg rekonstituiert / ml, ist das Protein in dem folgenden Puffer: 2 mM Tris pH 7,6, 0,5 mM MgCl 2. 0,5% Saccharose, 0,1% Dextran. Die Proteinkonzentration wird durch die Precision Red Erweiterte Protein-Assay-Reagenz (Cat # ADV02) bestimmt.
Für andere Formen der Cdc42 sowie viele andere gereinigte kleine G-Proteine, unsere kleine G-Protein-Produkt-Seite.
Reinheit
Die Reinheit wird durch Scanning-Densitometrie der Proteine auf SDS-PAGE-Gelen bestimmt. Proben> 90% rein, die Hauptverunreinigung mit 28 kDa läuft GST-Protein.
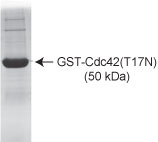
Abbildung 1: GST-Cdc42 (T17N) Reinheitsbestimmung. 10 ug C17G01 wurde auf einem SDS-PAGE-Gel und gefärbt mit Coomassie-Blau läuft
Biologische Aktivität
Aktivität von Cdc42 (T17N) wurde durch die Fähigkeit des Proteins überprüft GEF Aktivierung von Wildtyp-Cdc42 in einem in vitro-Assay-GEF (Cat # BK100) zu hemmen.
Frage 1: Nachdem das lyophilisierte Protein mit Wasser rekonstituiert, was die Zusammensetzung den das dominant-negative menschliche Puffer Cdc42 Protein ist in?
Antwort 1: Das Protein sollte durch die Zugabe von 25 ul destilliertem Wasser auf 1 mg / ml rekonstituiert werden. Das Protein wird dann in dem folgenden Puffer: 10 mM Tris pH 7,5, 10 mM NaCl, 0,3 mM MgCl 2. 1,0% Saccharose und 0,2% Dextran. Um eine hohe biologische Aktivität des Proteins zu erhalten, ist es empfohlen, dass die Proteinlösung mit 1 mM DTT zu einer Endkonzentration ergänzt werden
Frage 2: Was ist der empfohlene Weg, das Wildtyp-Cdc42-Protein zu speichern hohe Aktivität aufrecht zu erhalten?
Antwort 2: Um ein hohe biologische Aktivität des Proteins zu erhalten, wird dringend empfohlen, dass die Proteinlösung mit DTT 1 mM Endkonzentration ergänzt werden, portioniert in Experiment bemessen Mengen, in flüssigem Stickstoff eingefroren und bei -70 ° C gelagert C. Das Protein ist stabil für 6 Monate bei -70 ° C gelagert. Das Protein soll nicht auf wiederholte Gefrier-Auftau-Zyklen ausgesetzt werden. Das gefriergetrocknete Protein ist für 1 Jahr stabil bei Lagerung ausgetrocknet zu <10% humidity at 4°C.
Frage 3: Was ist die Mutation, dass das Cdc42-Protein hat, dass sie dominant negative macht?
Antwort 3: Dieses Protein hat ein Threonin an Asparagin-Substitution bei Aminosäure 17.