Chemie 104 Synthese von Aspirin
Chemie 104: Synthese von AspirinINTRODUCTION
Aspirin (Acetylsalicylsäure) ist ein synthetisches organisches von Salicylsäure abgeleitet. Salicylsäure ist ein natürliches in der Rinde der Weide gefunden Produkt und wurde von den alten Griechen und Native Americans, unter anderem zur Bekämpfung von Fieber und Schmerzen eingesetzt. Allerdings ist Salicylsäure bitter und reizt den Magen.
In diesem Experiment werden Sie Aspirin (Acetylsalicylsäure, C9 H8 O4), reinigen sie und bestimmen die prozentuale Ausbeute synthetisieren. Die Reinheit des Produkts wird durch qualitative Analyse bestätigt werden und durch ihren Schmelzpunktbereich zu messen.
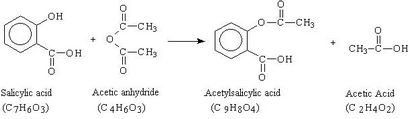
Die Reaktion, die für die Synthese verwendet wird, ist unten gezeigt. In dieser Reaktion wird ein Überschuß an Essigsäureanhydrid (C4 H6 O3) in eine gemessene Masse von Salicylsäure (C7 H6 O3) in Gegenwart eines Katalysators gegeben, Schwefelsäure (H2 SO4). Die Mischung wird erhitzt, um die Acetylsalicylsäure (C9 H8 O4) und Essigsäure (C 2 H 4 O 2) zu bilden. Nach dem die Reaktion stattfindet, wird Wasser zugegeben, um das überschüssige Essigsäureanhydrid zu zerstören und bewirken, dass das Produkt kristallisieren. Das Aspirin wird dann gesammelt, durch Umkristallisation gereinigt, und seine Schmelztemperatur gemessen.
Verwenden Sie sie nur in der Haube und sicher sein, die Haube Lüfter ist auf! Handschuhe tragen, wenn diese Chemikalien. Überschüssige Chemikalien müssen in der Kunststoffwanne Wasser entsorgt werden. Dadurch wird das Essigsäureanhydrid zu Essig umwandeln und die verdünnte Schwefelsäure. Wenn Sie eine Menge entweder von diesem verschütten, benachrichtigen Sie Ihren Lehrer.
Experimentelles Verfahren für die Synthese von ASPIRIN
1. Setzen Sie auf Ihren CHEMICAL spritzwassergeschützt Schutz benutzen!
2. Hinzufügen Die Ausgangsmaterialien
A. Mit einem Boot wiegen. abwiegen 5,00 g (+ 0,01 g) Salicylsäure (C7 H6 O3). Übertragen diese in einen 125 ml-Erlenmeyerkolben, wobei ein Pulvertrichter. Notieren Sie sich diese Masse auf dem Datenblatt.
C. Vorsichtig 8 Tropfen konzentrierter Schwefelsäure (18 M H 2 SO 4), einen Katalysator, in den Kolben.
3.e Heizung Der Ausgangsmaterialien
A. Auf dem Labortisch, montiert ein heißes Wasserbad eines 600 oder 800 ml Becher und die Kolbe wird im Wasserbad unter Verwendung von wie in Abbildung 1 gezeigt Vergewissern Sie sich, dass das Wasserbad direkt unter der Haube auf dem Labortisch befindet.
B. Ort der Kolben im Wasserbad und Wärme. Nachdem das Wasser beginnt Wärme für weitere 15 Minuten kochen lassen. (Hinweis: das Heißwasserbad später wieder in dem Verfahren verwendet werden.)
4. Kühlen der Reaktionsmischung
A. Nach dem Erhitzen, schalten Sie den Bunsenbrenner aus und entfernen Sie vorsichtig den Kolben aus dem Wasserbad (nicht vergessen, es ist heiß!) Und lassen Sie den Kolben und der Inhalt auf dem Labortisch für ca. 3 Minuten abkühlen lassen.
Beschriften C. Ihr Kolben, der das Reaktionsgemisch und legen Sie sie in einem Eisbad und kühlen, bis die Kristallisation des Aspirin vollständig erscheint (ca. 15 Min.).. Wenn Kristalle nicht angezeigt werden, können Sie die Wände des Kolbens mit einem Rührstab kratzen Kristallisation zu induzieren.
5. Isolierung des Produkts
A. Sammeln des Feststoffs Aspirin ein Büchner-Trichter und Filterpapier unter Verwendung des in Figur 2 gezeigten unbedingt das Filterpapier in dem Filter mit einer geringen Menge an Wasser setzen.
B. Spülen der Kolben zweimal mit 3 ml eiskaltem Wasser, um alle zurückbleibenden Kristalle zu entfernen.
C. Verwerfen des Filtrats links in der Saugflasche in den Abfallbehälter unter der Haube.
6. Umkristallisieren des Aspirin
A. Überweisungs so viel von den festen wie möglich aus dem Büchner-Trichter zu einem sauberen, trockenen 250-ml-Becher.
B. In 10 ml 95% igem Ethanol in den Becher und, falls erforderlich, warm (nicht kochen!), Um die Mischung im Wasserbad um die Kristalle aufzulösen. Wenn die Kristalle alle nicht auflösen, 2 mL mehr des Ethanols und auch weiterhin die Mischung erwärmen um die Kristalle aufzulösen.
C. Wenn die Kristalle sich alle aufgelöst, 10 ml deionisiertes Wasser, decken das Becherglas mit einem Uhrglas. und lassen Sie die Lösung ungestört für etwa 10 Minuten langsam auf dem Labortisch zu kühlen.
D. Nach den 10 Minuten auf dem Labortisch Abkühlen wird die Kristallisation durch den Becher und den Inhalt im Eisbad platzieren. (Beschriften Sie Ihre Becher!) Kristalle sollten bilden. Wenn ein „Öl“ anstelle eines festen erscheint, den Becher in dem heißen Wasserbad erhitzen, bis das Öl verschwindet. Wenn Kristalle nicht angezeigt werden, können Sie den Boden des Bechers mit einem Rührstab kratzen Kristallisation zu induzieren.
7. Trocknen des gereinigten Aspirin
A. einen sauberen Kreis von Filterpapier verwenden, sammelt die gereinigte Aspirin durch nach wie vor Absaugen.
B. Trocknen Sie die Kristalle von Luft durch sie für etwa 15 Minuten ziehen. (Verwerfen des Filtrat links in der Saugflasche in den Abfallbehälter unter der Haube. Spülen Sie die Saugflasche mit Wasser und entsorgen das Spülwasser in die Abfallbehälter unter der Haube.)
C. Platz das Aspirin auf ein verdoppelte Stück Papiertuch und beiseite zu trocknen, während die qualitative Analyse der Aspirin durchgeführt wird. (WASH Filtertrichter mit Wasser und entsorgen das Spülwasser in die Abfallbehälter unter der Haube.)
8. Analyse der Aspirin-Qualität
A. Die Anwesenheit von nicht umgesetztem Salicylsäure in dem synthetisierten Aspirin kann mit dem Eisen (III) chlorid-Test nachgewiesen werden.
1. Es werden etwa 1 ml entionisiertem Wasser auf fünf saubere 10-cm Reagenzgläser. Unter Verwendung einer sauberen Rührstab, legen einen Kristall von Salicylsäure in das erste Reagenzglas. In der zweiten, legen Sie ein Kristall aus pulverisiertem kommerziellen Aspirin, und in der dritten, legen Sie einen Kristall Ihrer synthetisierten Aspirin. Das vierte Teströhrchen ist die Kontrolle.
2. Zu jedem Teströhrchen 1 Tropfen von Eisen (III) -chlorid) -Lösung hinzu. Schüttelt jedes Teströhrchen und beobachtet, um die Farben hergestellt. Nehmen Sie Ihre Beobachtungen und Schlussfolgerungen auf dem Datenblatt.
B. Messen Sie den Schmelzpunktbereich des synthetisierten Aspirin mit dem Gerät Meltemp wie von Ihrem Labor Lehrer unter Beweis gestellt und für reine Aspirin von 138-140 o C. Nehmen Sie die Schmelztemperatur auf dem Datenblatt auf den Wert vergleichen.
9. Berechnung der prozentuale Ausbeute von Aspirin
A. Man wiegt das Aspirin und Berechnen der theoretischen (maximal) Ausbeute. [Anmerkung: Das Essigsäureanhydrid wird im Überschuß und die Salicylsäure ist das beschränkende Reagens. Verwenden Sie die Salicylsäure die theoretische Ausbeute zu berechnen.]
B. Basierend auf Prozent Ausbeute, Eisen (III) chlorid-Test, und der Schmelzpunkt-Bereich gemessen, eine Aussage über den Erfolg der Synthese zeichnen.
Legen Sie C. Ihr Aspirin im Glas mit „Studenten Prep Aspirin“.
Chemie 104: Synthese von Aspirin