Chemische Reaktionen (Verfahren) Klasse 9 Chemie Amrita Online Lab
Schlüsse:
- Magnesium ist ein silberweißes Metall, das in der Luft verbrennt, und verwendet atmosphärischen Sauerstoff aus Luft Magnesiumoxid zu bilden.
- Magnesiumoxid ändert sich die Farbe des roten Lackmuspapier zu blau. Diese Reaktion zeigt, daß Magnesiumoxid in basischer Natur ist.
- Die Bildung von Magnesiumoxid ist eine direkte Kombination Reaktion von zwei Elementen: Magnesium und Sauerstoff. Magnesiumoxid ist völlig verschieden von dem Reaktanten Magnesium und Sauerstoff. So ist diese Reaktion eine chemische Veränderung.
Vorsichtsmaßnahmen:
- Die Oberfläche des Magnesiumbandes sollte richtig mit Sandpapier gereinigt werden.
- Die weiße Asche aus Magnesiumoxid sollte nicht berührt werden.
- Magnesiumband sollte von einer Zange gehalten werden, während es brennt.
- Es ist besser, Sonnenbrille zu verwenden, die Augen zum Schutz vor grellem Licht Magnesiumband brennt.
Benötigte Materialien:
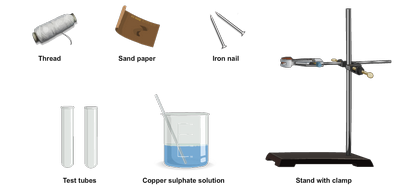
Lab Vorgehensweise:
- Saubere zwei Eisennägel von ausreichender Größe, indem sie mit Sandpapier zu reiben, so dass ihre Farbe grau erscheint.
- Nehmen ausreichende Menge an Kupfersulfatlösung in zwei Teströhrchen und fixiert ein Reagenzglas in jedem Gerüst.
- Tie einen Eisennagel mit einem Gewinde und hängen sie in einem Teströhrchen, so dass es vollständig in Kupfersulfatlösung eingetaucht ist. Binden Sie das andere Ende des Fadens mit dem Ständer.
- Halten Sie den anderen Nagel in einer Petrischale für den Vergleich nach dem Experiment.
- Halten Sie die beiden Reagenzgläser für etwa 15 min ungestört.
- Nach 15 min. die Eisennagel entfernen in Kupfersulfatlösung eingetaucht und in die Petrischale gelegt.
Beobachtungen:
- Es ist eine braune Beschichtung auf dem Eisennagel, die in der Kupfersulfat-Lösung eingetaucht wurden, während der Eisennagel in Petrischale gegeben zeigt gräuliche Farbe von Eisen.
- Die Farbe der Lösung von Kupfersulfat in dem der Eisennagel wurde leicht grünlich getaucht dreht, während die Lösung von Kupfersulfat in dem anderen Teströhrchen nicht ändert.
Schlüsse:
- Dies ist eine einzelne Verdrängungsreaktion, bei dem Kupfer aus Kupfersulfatlösung und eine neue Verbindung, Eisensulfat durch Eisen verschoben ist, gebildet wird. So ist diese Reaktion eine chemische Veränderung.
Vorsichtsmaßnahmen:
- Reinigen Sie die Eisennägel, indem sie mit Sandpapier Reiben Rost, Staub oder fettige Oberfläche zu entfernen.
- Halten Sie das Kontrollexperiment die Farbe von Eisennägeln und Kupfersulfatlösung zu vergleichen.
- Vermeiden Sie die Berührung Kupfersulfatlösung oder einen Nagel eingetaucht in Kupfersulfatlösung. Als Kupfersulfat ist giftig.
Benötigte Materialien:

Lab Vorgehensweise:
- Nehmen Sie eine kleine Menge an Kupfersulfatkristalle in einem trockenen Siederohres.
- Halten Sie das kochende Rohr mit einem Reagenzglashalter.
- Erhitzen Sie das kochende Rohr über der Flamme eines Brenners zuerst sanft und dann stark.
- Beachten Sie die Farbe von Kupfersulfat-Kristalle nach einiger Zeit erhitzt wird.
- Beachten Sie die Wassertröpfchen an den Seiten des Siederohres.
- Entfernen Sie das Siederohres von der Flamme und cool.
- 2-3 Tropfen Wasser auf der Probe von Kupfersulfat nach dem Erhitzen erhalten.
Beobachtungen:
- Beim Erhitzen ändert sich die Farbe der Kupfersulfatkristalle von blau zu weiß.
- Es gibt Wassertröpfchen an den Wänden des Siederohres.
- Bei Zugabe von 2-3 Tropfen Wasser weiß Kupfersulfat wird blau.
Schlüsse:
- Kupfersulfatkristalle enthalten Kristallwasser (CuSO4 .5H2 O).
- Beim Erhitzen verliert hydratisiertem Kupfersulfat sein Wassermolekül und bildet weißes Farbiges, wasserfreies Kupfersulfat.
- Auf der Zugabe von Wasser wasserfreies Kupfersulfat Änderungen an hydratisiertem Kupfersulfat.
- Es ist eine reversible chemische Veränderung.
Vorsichtsmaßnahmen:
- Halten Sie den Mund des Röhrchens weg von Ihrem Gesicht und auch von anderen Mitschülern.
- Verwenden Sie immer Reagenzglashalter, während das Reagenzglas erhitzt wird.
- Nehmen Sie eine kleine Menge von Kupfersulfat-Kristallen.
Benötigte Materialien:
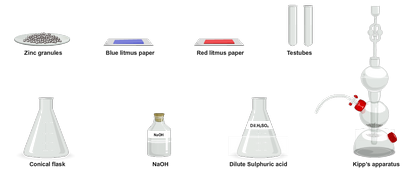
Lab Vorgehensweise:
- Nehmen Sie eine kleine Menge von dil. H2 SO4 in einem Erlenmeyerkolben.
- Fügen Sie eine kleine Menge von Zinkgranulat zu.
- Bringen eines nassen blauen und roten Lackmuspapier in der Nähe der Mündung des Erlenmeyer-Kolben einer nach dem anderen.
- Cork der Kolben mit einem einen gebohrten Kork und Einfügen eines Strahlrohrs durch das Loch in den Korken.
- Bringen Sie eine brennende Kerze in der Nähe der Mündung des feinen Strahlrohr.
- Gießen Sie eine kleine Menge der Lösung aus den Erlenmeyer-Kolben in ein Reagenzglas.
- In einigen Tropfen Natronlauge hinein. Ein weißer gallertartiger Niederschlag bildet.
- Ein Überschuss von NaOH in den gallertartigen Niederschlag.
- Der Niederschlag löst sich in Überschuß von NaOH.
- Nehmen Sie eine kleine Menge der Lösung in ein anderes Teströhrchen gegeben und passieren H2 S-Gas durch Kipps Apparat verwendet wird.
- Ein weißer Niederschlag bildet.
Beobachtungen:
- Nach der Zugabe von Zink Körner verd. H 2 SO 4 Entwicklung von Gasblasen auftritt.
- Das Gas kommt nicht aus, die Farbe der blauen und roten Lackmus Papiere.
- instantan mit einer kleinen Explosion auf die Flamme gebracht wird, verbrennt das Gas aus dem Strahlrohr kommt und eine Popsound erzeugen und die Flamme gut aus.
- Bei Zugabe von NaOH zu der geringen Menge an Lösung entnommen aus den Erlenmeyer-Kolben, weißer gallertartiger Niederschlag gebildet wird, der über NaOH löslich ist.
- Beim Passieren Schwefelwasserstoffgas durch die Lösung genommen im Reagenzglas ein weißer Niederschlag gebildet.
Schlüsse:
- Zink reagiert mit dil.H2 SO4 Zinksulfat zu bilden, und Wasserstoffgas zu entwickeln.
- Der Test mit roten und blauen Lackmus Papieren zeigt, dass Wasserstoffgas weder sauer noch basisch in der Natur.
- NaOH reagiert mit ZnSO4 einen weißen gallertartigen Niederschlag von Zinkhydroxid (Zn (OH) 2) zu bilden, die über NaOH löslich ist.
- ZnSO4 reagiert mit H2 S einem weißen Niederschlag von Zinksulfid (ZnS) zu bilden.
- Zinkmetall ist reaktiver als Wasserstoff.
- Dies ist eine einzelne Verdrängungsreaktion eines Nichtmetall durch ein Metall.
- ZnSO4 ist etwas ganz anderes in der chemischen Zusammensetzung und chemischen Eigenschaften als Zn und H 2 SO 4. So ist es eine chemische Veränderung
Vorsichtsmaßnahmen:
- Verwenden Sie die umsichtig Chemikalien.
- Nicht einatmen Gas direkt weiterentwickelt.
- Wasserstoffgas verbrennt sofort mit milder Explosion. Daher soll ein feines Strahlrohr die Verbrennung von Wasserstoff zu sehen, verwendet werden.
- Griff Säuren und Laugen sorgfältig.
Benötigte Materialien:
Lab Vorgehensweise:
Überwachung:
- Bei Zugabe von Natriumsulfat zu Bariumchlorid ein weißer Niederschlag wird sofort gebildet, die in dil.HCl unlöslich ist.
Schlüsse:
- Natriumsulfat reagiert chemisch mit Bariumchlorid in Form ihrer wässrigen Lösung mit einem weißen Niederschlag von Bariumsulfat zu bilden.
- Diese Reaktion ist eine chemische Veränderung, wie die Produkte vollständig verschieden von den Reaktanten in der chemischen Zusammensetzung und chemischen Eigenschaften sind.
Simulator Vorgehensweise:
Sie können die Reaktionen auswählen, indem Sie auf die entsprechenden Symbole klicken.
Brennen von Magnesium in Luft
- So schalten Sie den Brenner, klicken Sie auf den Knopf des Brenners.
- Klicken Sie auf die Zange das Magnesiumband zu verbrennen und die Asche in die Porzellanschale fallen.
- Sie können durch Klicken auf das Symbol Inferenz den Schluss sehen.
- Ziehen Sie den Spachtel und legte etwas Asche (MgO) in die drei Lackmus Papiere.
- Sie können durch Klicken auf das Symbol Inferenz den Schluss sehen.
- Sie können Ihr Ergebnis überprüfen, indem Sie auf die Symbole auf der rechten Seite gezeigt.
- Klicken Sie auf die ‚Reset‘ -Taste, das Experiment zu wiederholen.
Sublimation von Trockeneis
- Halten Sie einige Stücke von Trockeneis in eine Schüssel geben.
- Sie können sehen, dass ein Gas aus der Schale gebildet wird.
- Sie können durch Klicken auf das Symbol Inferenz den Schluss sehen.
- Sie können Ihr Ergebnis überprüfen, indem Sie auf die Symbole auf der rechten Seite gezeigt.
- Klicken Sie auf die ‚Reset‘ -Taste, das Experiment zu wiederholen.
Reaktion zwischen Natriumsulfat (Na 2 SO 4 (aq)) und Bariumchlorid (BaCl 2 (aq))
Reaktion von Eisennägeln mit Kupfersulfatlösung (CuSO & sub4; (aq))
- Sie können zwei Reagenzgläser mit Kupfersulfatlösung und zwei gereinigte Eisennägeln mit Gewinde sehen.
- Ziehen Sie ein Eisennagel in Richtung eines der Reagenzgläser es in Kupfersulfatlösung einzutauchen.
- Sobald ihre getan, warten, bis der Timer 15 Minuten zeigt.
- siehe Nach etwa 15 Minuten können Sie, dass die Farbe der Lösung von blau zu grün wechselt.
- Sie können durch Klicken auf das Symbol Inferenz den Schluss sehen.
- Klicken Sie auf das Gewinde Eisennagel aus dem Reagenzglas zu entfernen.
- Sie können eine braune Beschichtung auf dem Eisennagel sehen.
- Sie können durch Klicken auf das Symbol Inferenz den Schluss sehen.
- Sie können Ihr Ergebnis überprüfen, indem Sie auf die Symbole auf der rechten Seite gezeigt.
- Klicken Sie auf die ‚Reset‘ -Taste, das Experiment zu wiederholen.
Heizung von Kupfersulfat (CuSO4)
- So schalten Sie den Brenner, klicken Sie auf den Knopf des Brenners.
- Um das hydratisierten Kupfersulfat zu erhitzen, zieht die siedenden Rohrhalter in Richtung des Brenners.
- Der Brenner schaltet sich automatisch aus, wenn blau gefärbte Kupfer sulpahte Kristalle ihre Farbe wechselt auf Weiß.
- Sie können durch Klicken auf das Symbol Inferenz den Schluss sehen.
- Ziehen Sie den Tropfer auf dem Becher destilliertes Wasser zu nehmen und zieht ihn zurück in Richtung der Siederohres Wasser in das kochende Röhrchen mit wasserfreiem Kupfersulfat zuzugeben.
- Sie können durch Klicken auf das Symbol Inferenz den Schluss sehen.
- Sie können Ihr Ergebnis überprüfen, indem Sie auf die Symbole auf der rechten Seite gezeigt.
- Klicken Sie auf die ‚Reset‘ -Taste, das Experiment zu wiederholen.
- Nehmen Sie einige Eiswürfel in eine Schüssel geben und halten es für einige Zeit.
- Sie können durch Klicken auf das Symbol Inferenz den Schluss sehen.
- Sie können Ihr Ergebnis überprüfen, indem Sie auf die Symbole auf der rechten Seite gezeigt.
- Klicken Sie auf die ‚Reset‘ -Taste, das Experiment zu wiederholen.
Reaktion von Zink mit verdünnter Schwefelsäure
Sie können die Identifizierungstests auswählen, indem Sie unten auf die jeweiligen Symbole klicken.
- Zinkgranulat in verdünnte Schwefelsäure, ziehen den Spatel in Richtung des Reagenzglases hinzuzufügen.
- Sie können durch Klicken auf das Symbol Inferenz den Schluss sehen.
- Ziehen Sie das Lackmus-Papiere eines nach dem anderem über den Mund des Reagenzglas seine Reaktion mit dem Gas aus dem Reagenzglas zu überprüfen kommen.
- Sie können durch Klicken auf das Symbol Inferenz den Schluss sehen.
- Sie können Ihr Ergebnis überprüfen, indem Sie auf die Symbole auf der rechten Seite gezeigt.
- Klicken Sie auf die ‚Reset‘ -Taste, das Experiment zu wiederholen.
- Ziehen des Spatels in Richtung des Reagenzglases zu Zinkgranulat in das Reagenzglas hinzu enthält dil. H 2 SO 4.
- Zum Schließen wird das Teströhrchen, ziehen die einzelnen gebohrten Kork, in der ein feines Strahlrohr, auf das Testrohr eingeführt.
- Ziehen Sie die brennende Kerze in Richtung der Mündung des feinen Strahlrohr.
- Sie können durch Klicken auf das Symbol Inferenz den Schluss sehen.
- Sie können Ihr Ergebnis überprüfen, indem Sie auf die Symbole auf der rechten Seite gezeigt.
- Klicken Sie auf die ‚Reset‘ -Taste, das Experiment zu wiederholen.
- Ziehen des Spatels in Richtung des Reagenzglases zu Zinkgranulat in das Reagenzglas hinzu enthält dil. H 2 SO 4.
- Sie können durch Klicken auf das Symbol Inferenz den Schluss sehen.
- Warten Sie einige Zeit, um die Reaktion zu vervollständigen.
- Ziehen Sie den Tropfer hinzuzufügen NaOH in das Teströhrchen, die Zinksulfatlösung.
- Klicken Sie auf dem Reagenzglas den Inhalt des Reagenzglas gut zu schütteln.
- Sie können durch Klicken auf das Symbol Inferenz den Schluss sehen.
- Wiederum ziehen die Pipette über NaOH in das Reagenzglas hinzuzufügen.
- Klicken Sie auf dem Reagenzglas den Inhalt des Reagenzglas gut zu schütteln.
- Sie können durch Klicken auf das Symbol Inferenz den Schluss sehen.
- Sie können Ihr Ergebnis überprüfen, indem Sie auf die Symbole auf der rechten Seite gezeigt.
- Klicken Sie auf die ‚Reset‘ -Taste, das Experiment zu wiederholen.
- Ziehen des Spatels in Richtung des Reagenzglases zu Zinkgranulat in das Reagenzglas hinzu enthält dil. H 2 SO 4.
- Sie können durch Klicken auf das Symbol Inferenz den Schluss sehen.
- Warten Sie einige Zeit, um die Reaktion zu vervollständigen.
- H2 S-Gas durch die Lösung zu passieren, zieht das Teströhrchen in Richtung der Kipp-Apparatur.
- Klicken auf den Knopf des Kippscher Apparat um es zu öffnen und H2 S-Gas durch die Lösung in dem Teströhrchen übergeben.
- Klicken Sie auf den Knopf von Kipps Apparat um es zu schließen.
- Klicken Sie auf dem Reagenzglas den Inhalt des Reagenzglas gut zu schütteln.
- Sie können durch Klicken auf das Symbol Inferenz den Schluss sehen.
- Sie können Ihr Ergebnis überprüfen, indem Sie auf die Symbole auf der rechten Seite gezeigt.
- Klicken Sie auf die ‚Reset‘ -Taste, das Experiment zu wiederholen.
Hinweis: Klicken Sie auf die ‚HELP‘ -Taste, um die Anweisungen zu sehen.
Vorsichtsmaßnahmen:
- Verwenden Sie die umsichtig Chemikalien.
- Halten Sie den Mund des Röhrchens weg von Ihrem Gesicht und auch von anderen Mitschülern.
- Behandeln Sie die Säuren und Laugen sorgfältig.