Cyclohexan Konformation - Jedipedia
A Cyclohexan-Molekül in Sessel-Konformation. Wasserstoffatome in axialen Positionen sind rot dargestellt, während die in äquatorialen Positionen in blau sind.
Historischer Hintergrund
Sesselkonformation
Aufgrund der inhärenten Tendenz der sp³ -Hybridorbitalen (und damit die Kohlenstoff-Wasserstoff-Bindungen) an vierwertigen Kohlenstoffbindungswinkel von 109,5 ° zu bilden, wird Cyclohexan keine planare hexagonale Anordnung mit Innenbindungswinkeln von 120 ° bilden. Die Sessel-Konformation ist ein Begriff für die stabilste chemische Konformation eines sechsgliedrigen einfach gebundenen Kohlenstoffrings wie Cyclohexan verwendet. Derek Barton und Odd Hassel beide gemeinsam den Nobelpreis für die Arbeit an den Konformationen von Cyclohexan und verschiedenen anderen Molekülen.
In der niedrigsten Energie Sessel-Konformation, 6 der 12 Wasserstoffatom in axialen Positionen sind (rot gefärbt) sind -Ihre CH-Bindungen parallel zueinander und erscheinen haften nach oben und unten aus der Ringstruktur sind die andere 6 äquatorial ( blaue Farbe) -Sie sind um den Umfang des Rings gespreizt. Man beachte, dass zusätzlich ein Wasserstoff an jeder Position „up“ ist relativ zu den anderen an dieser Position „unten“ ist.
Die Bevorzugung eines Substituenten in Richtung der äquatorialen Konformation wird im Hinblick auf seine A-Wert gemessen. das ist die Gibbs'sche freie Energiedifferenz zwischen dem äquatorialen und den axialen Konformeren. Ein positiver Wert zeigt eine Präferenz gegenüber der äquatorialen Position. Die Größe des A-Wertes im Bereich von nahezu Null für sehr kleine Substituenten, wie Deuterium. bis etwa 5 kcal / mol für sehr sperrige Substituenten, wie die tert-Butylgruppe.
Bootkonformation
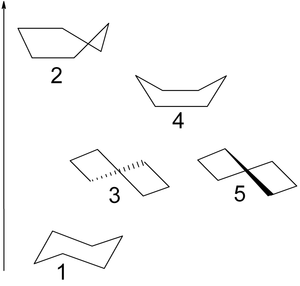
Neben die Sessel-Konformation (1) mit D3d Symmetrie cyclohexan kann auch in dem Halb Stuhl oder Hülle vorhanden ist (2), Twist oder Verdrehungsboot (3,5) mit D2 Symmetrie und Boot (4) Konformeren. Nur die Twist Form ist isolierbar als - wie der Stuhl Form - es ist eine Mindestenergie darstellt. Die Bootkonformation leidet nicht unter Winkelspannung, aber eine höhere Energie als die Sesselform aufgrund sterischer von den beiden axialen 1,4-Wasserstoffatom, resultierenden Stamm in Wechselwirkung, was die flagpole genannt wird. Die Torsionsspannung in der Bootkonformation hat einen Maximalwert, weil zwei der Kohlenstoffbindungen verdunkelt werden. Man vergleiche dies mit dem Stuhl mit allen Bindungen gestaffelt und vollständige Abwesenheit von Torsionsspannung und das Twist-Boot mit 4 aus 6-Bindungen teilweise überlagert. In der Halbsesselform 4 Kohlenstoffatome werden auf einer Ebene angeordnet, in der zwei Bindungen vollständig verdunkelt werden.
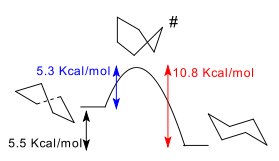
Die Boot und Umschlagformen sind Übergangszustände zwischen den Drall Formen und der Drall und Stuhlformen sind, und sind nicht zu isolieren. Die drall Bootkonformation beträgt 5,5 kcal / mol (23 kJ / mol) weniger stabil als die Sessel-Konformation. Die Energien der beiden Übergangszustände sind 6,6 kcal / mol (28 kJ / mol) (Boot) und 10,8 kcal / mol (45 kJ / mol) (Halbstuhl) höher ist als die des Sessels. [4] Der Flipping Prozess Ring kann jetzt mit mehr Präzision stattfindet durch eine Twist-Boot-Konformation und durch zwei Halbstuhlgangszustände beschrieben.
Der Unterschied in der Energie zwischen dem Stuhl und der Twist-Boot-Konformation von Cyclohexan kann, indem die Differenz der Aktivierungsenergie für die Umwandlung des Stuhls zu der Twist-Boot-Konformation und der die Rückisomerisierung indirekt gemessen werden. Die Konzentration des Drall-Boot-Konformation bei Raumtemperatur ist sehr niedrig (weniger als 0,1%), aber bei 1073 Grad Kelvin diese Konzentration 30% erreichen kann. Die umgekehrte Reaktion wird durch IR-Spektroskopie gemessen wird, nachdem rasch Cyclohexan Abkühlen von 1073 K bis 40 K, in der großen Konzentration von drall Bootkonformation einfriert.
[6.6] Chiralane [5] [6] ist ein T-Molekül Punktgruppe vollständig zusammengesetzt aus identischem verschmolzenen Twist-Boot Cyclohexane. Twistan ist eine weitere Verbindung mit einer Twist-Boot-Konformation gezwungen.
Cyclohexanderivate
Substituenten am Cyclohexan gefunden adoptieren cis und trans-Formationen und nicht leicht durch einfache Einzelsigmabindung Drehung wie bei linearen Molekülen umgeschaltet werden können. Cis Bildung bedeutet, daß beide Substituenten an der oberen Seite der 2 -Substituent Platzierungen auf dem Kohlenstoff zu finden sind, während trans würde bedeuten, dass sie sich auf gegenüberliegenden Seiten waren. Trotz der Tatsache, dass Kohlenstoff auf Cyclohexan durch eine Einfachbindung verbunden sind, bleibt der Ring starr, in diesem Umschalten von cis zu trans erfordern würde, um den Ring zu brechen. Die Nomenklatur für cis genannt (Z), während der Name für trans (E) vor dem IUPAC Name platziert werden.
Für disubstituiert Cyclohexanringen (d.h. zwei Gruppen an dem Ring), die relative Orientierung der beiden Substituenten beeinflussen die Energie der möglichen Konformationen. Für 1,2- und 1,4-disubstituiertes Cyclohexan, eine cis-Konfiguration führt zu einem axialen und einer äquatorialen Gruppe. Diese Konfiguration kann Stuhl Flipping unterziehen. Für 1,2- und 1,4-disubstituiertes Cyclohexan, einer trans-Konfiguration führt zu entweder beide Gruppen axialen oder äquatorialen beide. In diesem Fall wird die diaxiale Konformation effektiv durch seine hohe sterische Spannung verhindert (vier gauche-Wechselwirkungen über die diäquatoriale). Für 1,3-di-substituierte Cyclohexane, ist die cis-Form und die diäquatoriale blätterte Konformation leidet zusätzliche sterische Wechselwirkung zwischen den beiden axialen Gruppen. Trans -1,3-di-substituierte Cyclohexane sind wie cis -1,2 und -1,4-cis und kann zwischen den zwei äquivalenten axial / äquatorial Formen spiegeln.
Derivate von Cyclohexan bestehen, die eine stabilere Twist-Boot-Konformation hat. Ein Beispiel ist 1,2,4,5-Tetrathian, eine Organoschwefelverbindung mit 4 Methylen durch eine Sulfidgruppe ersetzt Gruppen was folglich unvorteilhaft 1,3-diaxiale Wechselwirkungen zu entfernen. Im analogen tetramethyl- 3,3,6,6-tetramethyl-1,2,4,5-Tetrathian der drall Bootkonformation dominiert tatsächlich. Auch in Cyclohexan-1,4-dion mit der sterischen 1,4-Wasserstoff Wechselwirkung entfernt, die eigentliche stabile Konformation ist das Twist-Boot.
Cis-1,4-di-tert-Butylcyclohexan eine axiale tert-Butyl-Gruppe in der Sessel-Konformation und die Umwandlung in die Konformation Orte Twist-Boot beide Gruppen in günstiger äquatorialen Positionen. Als Ergebnis ist der drall Bootkonformation stabileren um 0,47 kcal / mol (1,96 kJ / mol) bei 125 K, wie durch NMR-Spektroskopie gemessen.
Wirkung von polaren Substituenten [Bearbeiten]:
- cis-Cyclohexan-1,3-diol bevorzugt diaxiale Konformation "Bildung von intrahydrogen bond".
- 2,5-Di-tert-butyl-1,4-Cyclohexandiol in Boot oder Verdrillung Bootform "auch intra-H-Bindung"
- 2-Bromcyclohexanon bevorzugt a-Br "min.dipolar Abstoßung"
- 2-Brom-4,4-Dimethylcyclohexanon bevorzugt E-Br „1,3 diaxiale Wechselwirkung (-ve in e-Br) mehr als
dipolar Abstoßung [Bearbeiten]:
- trans-1,2-Dibromcyclohexan in axialer Form in unpolaren Lösungsmitteln "Dipole cancel"
während in equtorial Form in polaren Lösungsmitteln „Dipole verstärken“.