Fullerenchemie
Fullerenchemie ist ein Gebiet der organischen Chemie zu den chemischen Eigenschaften von Fullerenen gewidmet. [1] [2] [3] Die Forschung in diesem Bereich wird durch die Notwendigkeit angetrieben Fullerene und stimmen ihre Eigenschaften funktionalisieren. Zum Beispiel Fulleren ist notorisch unlösliche und Zugabe eine geeignete Gruppe, die Löslichkeit erhöhen kann. [1] Durch Zugabe einer polymerisierbaren Gruppe kann ein Fulleren Polymer erhalten werden. Funktionalisierte Fullerene sind in zwei Klassen unterteilt: exohedrale Fullerene mit Substituenten, außerhalb des Käfigs und Endohedrale Komplexe mit eingeschlossenen Moleküle innerhalb des Käfigs.
Dieser Artikel behandelt die Chemie des buckyballs, während die Chemie der Kohlenstoff-Nanoröhrchen in Kohlenstoff-Nanoröhrchen-Chemie abgedeckt ist.
Chemische Eigenschaften von Fullerenen bearbeiten
Aufgrund der Kugelform des Moleküls sind die Kohlenstoffatome stark pyramidalisiert. die weitreichende Konsequenzen für die Reaktivität hat. Es wird geschätzt, dass Dehnungsenergie 80% der Bildungswärme ausmacht. Die konjugierten Kohlenstoffatomen reagieren, von der Planarität von Orbital Rehybridisierung der sp²-Orbitale und pi-Orbitalen auf einen sp 2,27 orbital mit einer Verstärkung in p-Charakter der Abweichung. Die p Lappen erstrecken sich weiter außerhalb der Oberfläche, als sie in das Innere der Kugel zu tun, und dies ist einer der Gründe, ein Fulleren elektronegativ ist. Der andere Grund ist, dass das leer tief liegendes pi * Orbitale auch ein Zeichen s hohes hat.
Die Doppelbindungen in Fulleren sind nicht alle gleich. Zwei Gruppen können identifiziert werden: 30 sogenannte [6,6] Doppelbindungen verbinden zwei Hexagone und 60 [5,6] -Bindungen verbinden ein Sechseck und ein Fünfeck. Von den beiden sind die [6,6] -Bindungen kürzer mit mehr Doppelbindungscharakter und ist daher ein Sechseck oft als Cyclohexatrien und ein Fünfeck als Pentalen oder [5] Radialen dargestellt. In anderen Worten, obwohl die Kohlenstoffatome in Fulleren alle Überbau konjugiert sind, ist kein Super aromatische Verbindung. Die Röntgenbeugungswerte Bindungslänge sind 139,1 pm für die [6,6] -Bindung und 145,5 pm für die [5,6] -Bindung.
C60 Fulleren hat 60 pi-Elektronen, sondern eine geschlossene Schale Konfiguration erfordert 72 Elektronen. Das Fulleren ist in der Lage, die fehlenden Elektronen, die durch Reaktion mit Kalium zu erwerben zuerst die K zu bilden
6 C 6-
60-Salz und dann die K
12 C-12-
60 In dieser Verbindung der Bindungslängen Wechsel im Ausgangsmolekül beobachtet ist verschwunden.
Fullerene sind in der Regel als Elektro reagieren. Eine zusätzliche treibende Kraft ist Linderung des Stammes, wenn Doppelbindungen gesättigt werden. Schlüssel in dieser Art von Reaktion ist das Niveau der Funktionalisierung d.h. Monoadditions oder mehreren Additionen und im Falle mehrerer Additionen ihre topologische Beziehungen (neu Substituenten zusammengedrängt oder gleichmäßig beabstandet sind). In Übereinstimmung mit dem IUPAC-Regeln werden die Begriffe Methanofulleren verwendet, um das Ring geschlossen (Cyclo) Fullerenderivate, um anzuzeigen, und fulleroid zu öffnendem Ring (methanoannulene) Strukturen. [7] [8]
Nucleophile Addition bearbeiten
Fullerene reagiert als Elektro mit einer Vielzahl von Nucleophilen in nucleophilen Additionen. Der Intermediär gebildete Carbanion wird von einem anderen Elektrophil eingefangen. Beispiele für Nukleophile sind Grignard-Reagenzien und Organolithiumreagentien. Beispielsweise stoppt die Reaktion von C60 mit Methylmagnesiumchlorid quantitativ an dem penta-Adduktes mit den Methylgruppen um ein Cyclopentadienylanion zentrieren, die anschließend protoniert ist. [9] Eine weitere nucleophile Reaktion ist die Reaktion Bingel. Fulleren reagiert mit Chlorbenzol und Aluminiumchlorid in einer Friedel-Crafts-Alkylierung-Reaktion. In dieser Hydroarylierung ist das Reaktionsprodukt der 1,2-Addition-Addukt (Ar-CC-H). [10]
Pericyclische Reaktionen bearbeiten
Das [6,6] -Bindungen von Fullerenen reagieren als Dienophile in Dienen oder Cycloadditionen beispielsweise Diels-Alder-Reaktionen. 4-gliedrigen Ringe können durch [2 + 2] Cycloadditionen beispielsweise mit Didehydrobenzol erhalten werden. [11] [12] Ein Beispiel für eine 1,3-dipolare Cycloaddition zu einem 5-gliedriger Ring ist die Reaktion Prato.
Hydrierung bearbeiten
Fullerene sind durch mehrere Verfahren leicht hydriert. Beispiele für hydrofullerenes sind C60 H18 und C60 H36. Jedoch vollständig hydriert C60 H60 ist nur hypothetisch wegen der großen Belastung. Highly sind hydrierte Fullerene nicht stabil, da eine längere Hydrierung von Fullerenen durch direkte Reaktion mit Wasserstoffgas bei hohen Temperaturen resultiert in Käfigs Fragmentierung. Bei der abschließenden Reaktionsstufe bewirkt dies Zusammenbruch der Käfigstruktur mit der Bildung von polyzyklischen aromatischen Kohlenwasserstoffen. [13]
Oxidation bearbeiten
Obwohl schwieriger als Reduktion, Oxidation von Fulleren ist möglich, beispielsweise mit Sauerstoff und Osmiumtetraoxid.
Hydroxylierung bearbeiten
Fullerene können Fullerenole oder Fullerole hydroxyliert sein. Wasserlöslichkeit hängt von der Gesamtzahl der Hydroxylgruppen, die angebracht werden können. Ein Verfahren ist Fulleren Reaktion in verdünnten Schwefelsäure und Kaliumnitrat bis C60 (OH) 15. [14] [15] Eine andere Methode ist die Umsetzung in verdünntem Natriumhydroxid durch TBAH katalysierten Zugabe von 24 bis 26 Hydroxylgruppen steht. [16] Die Hydroxylierung wird auch lösungsmittelfreie NaOH / Wasserstoffperoxid berichtet werden. [17] C60 (OH) 8 hergestellt wurde, ein mehrstufiges Verfahren unter Verwendung von aus einem gemischten Peroxids Fulleren beginnen. [18] Die maximale Anzahl der Hydroxylgruppen, die (Wasserstoffperoxid-Verfahren) liegt bei 36-40 angebracht werden können. [19]
Elektrophile Additionen bearbeiten
Retro Ergänzungen bearbeiten
Protokolle wurden zur Entfernung von Substituenten über retroadditions untersucht, nachdem sie ihren Zweck erfüllt haben. Beispiele hierfür sind die Retro-Bingel-Reaktion und die Retro-Prato-Reaktion.
Carben-Additionen bearbeiten
Radical Ergänzungen bearbeiten
Fullerene können Radikalfänger in Betracht gezogen werden. [23] [24] mit einem einfachen Kohlenwasserstoffrest, wie beispielsweise den t-Butylrest der tBuC60 Radikal gebildet wird durch Thermolyse oder Photolyse eines geeigneten Vorläufer erhalten, die untersucht werden kann. Das ungepaarte Elektron ist delokalisieren nicht über den gesamten Bereich, sondern Positionen in der Nähe des tBu Substituenten in Anspruch nimmt.
Fullerene als Liganden bearbeiten
Fulleren ein Ligand in der organometallischen Chemie. Die [6,6] Doppelbindung elektronenarme und bildet in der Regel metallische Bindungen mit η = 2 Haptizität. Bindungsarten, wie beispielsweise η = 5 oder η = 6 können durch Modifikation der Koordinationssphäre induziert werden.
Open-Käfig Fullerene bearbeiten
Heterofullerenen bearbeiten
Fulleren-Dimere bearbeiten
Der C60-Fulleren dimerisiert in einer formalen [2 + 2] -Cycloaddition zu einer C120 Bucky dumbbell im festen Zustand durch Mechanochemie (Hochgeschwindigkeitsfräsen Schwingungs) mit Kaliumcyanid als ein Katalysator. [46] Das Trimer wird auch 4-aminopyridin als Katalysator (4% Ausbeute) berichtet wurde unter Verwendung von [47] und mit der Rastertunnelmikroskopie als Monoschicht beobachtet. [48]
Multistep Fullerensynthese bearbeiten
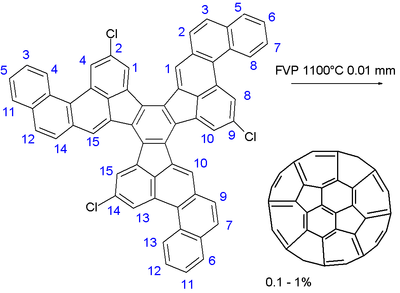
Im letzten Schritt besteht, die ein großer polycyclische aromatischer Kohlenwasserstoff von 13 Sechsecken und Fünfecken drei wurde vorgelegt Vakuumpyrolyse bei 1100 ° C und 0,01 Torr zu blinken. Die drei Kohlenstoff-Chlor-Bindungen diente als Radikal Inkubatoren und der Ball wurde in einem no-Zweifel komplexe Reihe von Radikalreaktionen vernäht. Die chemische Ausbeute war gering: 0,1 bis 1%. Ein kleiner Prozentsatz von Fullerenen ist in jedem Verfahren gebildet, das von Kohlenwasserstoffen beinhaltet Brennen, z.B. in Kerze brennt. Die Ausbeute durch ein Verbrennungsverfahren ist oft über 1%. Das Verfahren, das oben vorgeschlagene bietet keinen Vorteil für die Synthese von Fullerenen im Vergleich zu dem üblichen Verbrennungsverfahren, und daher wird die organische Synthese von Fullerenen bleibt eine Herausforderung für die Chemie.
Fulleren Reinigung wird das Verfahren zur Herstellung einer Fullerenverbindung frei von Verunreinigungen zu erhalten. In der Fulleren- Mischungen aus C60. C70 und höhere Homologe sind immer gebildet. Fullerene Reinigung ist der Schlüssel zur Fulleren Wissenschaft und bestimmt Fulleren Preise und den Erfolg der praktischen Anwendungen von Fullerenen. Die ersten verfügbaren Reinigungsverfahren für C60-Fulleren wurden mittels HPLC, aus der kleinen Menge an großem Aufwand erzeugt werden kann.
Ein praktischer Labormaßstab Verfahren zur Reinigung von Ruß in C60 und C70 angereichert beginnt mit der Extraktion in Toluol durch Filtration mit einem Papierfilter. Das Lösungsmittel wird verdampft und der Rückstand (die Toluol lösliche Fraktion Ruß) wieder aufgelöst in Toluol und einer Säulenchromatographie unterzogen. C60 eluierte zuerst mit einer purpurroten Farbe und C70 ist eine rötlich-braune Farbe nächste Anzeige. [53]
In Nanoröhrchen-Verarbeitung der etablierten Reinigungsverfahren zur Entfernung von amorphem Kohlenstoff und Metallen ist durch kompetitive Oxidation (oft ein Schwefelsäure / Salpetersäure-Mischung). Es wird angenommen, dass dieser Oxidations Sauerstoff enthaltenden Gruppen erzeugt (Hydroxyl. Carbonyl. Carboxyl) auf der Oberfläche, die elektrostatisch-Nanoröhrchen sie in Wasser stabilisieren und die später in der chemischen Funktionalisierung genutzt werden. Ein Bericht [54] zeigt, dass die Sauerstoffgruppen in Wirklichkeit verbinden sich mit Kohlenstoff-Verunreinigungen absorbiert das Nanoröhrchen Wand enthält, die durch eine einfache Basiswäsche entfernt werden können. Gereinigt Nanoröhrchen werden berichtet indikativ für weniger Funktionalisierung D / G-Verhältnis reduziert, und die Abwesenheit von Sauerstoff ist auch aus IR-Spektroskopie und Röntgen-Photoelektronenspektroskopie.
Experimentelle Reinigungsstrategien bearbeiten
Eine kürzlich Kilogramm-Maßstab Fulleren Reinigungsstrategie wurde von Nagata et al. [55] Bei diesem Verfahren C60 wurde aus einem Gemisch von C60 getrennt. C70 und höhere Fullerene Verbindungen, indem zunächst die Amidinverbindung DBU wurde zu einer Lösung der Mischung in 1,2,3-Trimethylbenzol Zugabe. DBU, da es nur stellt sich heraus reagiert, um C70-Fullerene und höher, die Reaktionsprodukte abzutrennen und kann durch Filtration entfernt werden. C60 Fullerene haben keine Affinität für DBU und anschließend isoliert. Andere Diaminverbindungen wie DABCO haben diese Selektivität nicht teilen.
C60 aber nicht C70 bildet eine 1: 2-Einschlußverbindung mit Cyclodextrin (CD). Ein Trennverfahren für die beiden auf diesem Prinzip basiert Fullerene wird durch Cyclodextrin zu kolloidalen Goldteilchen durch eine Schwefelbrücke -schwefel verankern. [56] Die Au / CD-Verbindung ist sehr stabil und löslich in Wasser und extrahiert selektiv C60 von der unlöslichen Mischung nach mehrtägigem Erhitzen unter Rückfluß. Die C70 Fullerenkomponente wird dann durch einfache Filtration entfernt. C60 wird durch Zugabe von Adamantol aus der Au / CD Verbindung ausgetrieben, die eine höhere Affinität zum Cyclodextrin-Hohlraum aufweist. Au / CD ist vollständig recycelt, wenn Adamantol wiederum wird durch Zugabe von Ethanol und Ethanol durch Verdampfung entfernt, ausgetrieben; 50 mg Au / CD einfängt 5 mg C60-Fulleren.