Herstellen einer Saline oder Natronlauge 6 Schritte

Ein Klassenzimmer geeignetes Verfahren zu Elektrolytlösungen jeglicher Stärke für Al-Luft oder mikrobiellen Brennstoffzellen zu machen, wenn eine Wärmequelle zur Verfügung steht. Auf dem Weg dorthin werden wir über die Berechnung Verhältnisse, Prozentsätze und Löslichkeit von anorganischen Chemikalien in Wasser erfahren. Plus diese Lösungen können mit anderen Projekten verwendet werden, um mit der Rolle Elektrolyte spielt in Brennstoffzellen und Batterien zu experimentieren.
Sobald Sie eine Flasche gesättigten Lösung haben, können Sie einen Teil davon nehmen und es mit destilliertem Wasser verdünnen nach unten (oder sogar Leitungswasser, wenn es nicht wichtig ist, zu genau zu sein) einem prozentualen Verhältnis Sie von 1% bis 99% wünschen, aber Sie müssen mit 100% Lösung beginnen, um eine genaue Verdünnung zu mischen.
Während ich auf Kochsalz der gleichen Techniken konzentrieren können, in dem späteren Schritt einen der anorganischen Verbindungen angepasst werden.
Schritt 1: Bill of Materials

Schritt 2: Erstellen Sie eine gesättigte Lösung




Eine gesättigte Lösung ist eine, bei der das Lösungsmittel (Wasser) hat sich ein Gleichgewicht zwischen dem gelösten und ungelösten Lösungsmittel erreicht. Was bedeutet das? Das Wasser hat alle chemischen absorbiert, die es halten kann.
Je wärmer das Wasser, desto mehr Chemikalie kann es halten. Also, was wir tun werden, ist das Wasser erwärmen (Ich schlage vor, 100 Grad, aber im Wesentlichen über Raumtemperatur siedet tun werden, ist auf jeden Fall nicht notwendig). Ich fand, dass Leitungswasser nicht heiß blieben lange genug und es war notwendig, eine Pfanne und den Ofen zu verwenden.
Sobald das Wasser erwärmt hat etwas Salz hinzufügen und rühren, bis sie vollständig gelöst. Wenn Sie eine Küchenwaage messen verwenden Sie etwa 100 g als Ausgangspunkt ausmessen können sonst nur einige in und rühren gießen. Wiederholen Sie diesen Vorgang, bis das Salz nicht mehr auflöst und nasser Salzkristalle erscheint auf dem Boden der Pfanne (siehe Bild). Es gibt keine besondere Gefahr zu viel in dem Hinzufügen aber keine Notwendigkeit, es zu übertreiben.
Der nächste Schritt wird kurz über die Löslichkeit verschiedener Haushaltschemikalien wie Lauge (Natriumhydroxid) oder Bittersalz sprechen und dann werden wir zu machen, Lösungen verschiedener Stärken suchen.
Schritt 3: Wie vielen Chemical Do I Need (Löslichkeit)
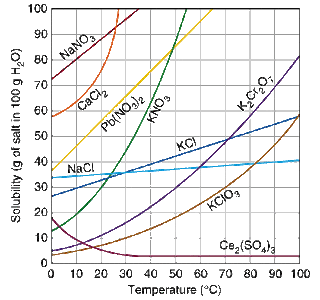
Die nachfolgende Tabelle enthält die Grunddaten für einige gängige anorganische Verbindungen. Die Chemikalie wird auf der linken Seite aufgelistet und die Menge der Substanz, die durch 100 ml Wasser bei verschiedenen Temperaturen aufgenommen werden kann, wird gezeigt. So, zum Beispiel Natriumchlorid bei 40 o C (ca. 100 °) werden 36,6 g Salz pro 100 ml oder etwa 183 g (etwa 0,4 lb) in 500 ml halten. Die meisten davon sind leicht verfügbar, die oft bei Ihrem örtlichen Baumarkt oder Hobbyspeicher mit Chemie liefert.
Schritt 4: Teile Teile - Berechnung Verdünnungen
Bevor wir eine tatsächliche Verdünnung machen werfen wir einen Blick darauf werfen, wie unterschiedliche Prozentsätze zu berechnen. Nun viel Sie werden sofort denken Sie an die Tabelle in der vorhergehenden Stufe und springen sofort auf einfache mathematische. Das ist ein wenig irreführend, da wir im nächsten Schritt eine 10% ige Lösungen enthalten 10 Vol% gesättigter Lösung, 10% Salz sehen. Die eigentliche Mathematik ist noch langweiliger so werden wir eine viel einfachere Methode nutzen, um unsere gewünschte Lösung zu erhalten.
So eine Verdünnung machen wir sie richtiges Verhältnis von gesättigter Lösung herauszufinden, „reines“ Wasser und mischen werden müssen.
Der Begriff ‚ein Teil‘ bezieht sich das gleiche Maß für die gesättigte Lösung und die „reinen“ Wasser zu verwenden. Angenommen, Sie haben ein Schnapsglas in der Hand halten und Sie füllen es mit der Master-Salzlösung, haben Sie jetzt ‚einen Teil‘ der Master-Lösung. Sie Dump, dass in ein Gefäß und Sie dann das gleiche Glas mit Wasser füllen und es in das Gefäß hinzuzufügen. Sie haben nun ‚einen Teil‘ Master-Salzlösung zu ‚einem Teil‘ destilliertes Wasser (: 1 Mischungsverhältnis, oder 1) gemischt. Dies führt zu einer 50% Reduktion der Konzentration oder eine 50% igen Lösung. (: 2-Verhältnis 1) Wenn Sie einen Teil Master Lösung nehmen und zwei Teile Wasser hinzufügen, werden Sie mit einer 33,3% Salzwasserlösung aufzuzuwickeln. Wenn Sie einen Teil der Lösung meistert und drei Teile destilliertes Wasser hinzufügen, haben Sie eine 25% ige Salzwasserlösung (Verhältnis 1: 3). Wenn Sie einen Teil Master Lösung nehmen und vier Teile destilliertes Wasser hinzufügen, haben Sie jetzt eine 20% ige Salzwasserlösung (Verhältnis 1: 4).
Unter Verwendung des Verfahrens ‚Teile‘, wenn man lediglich die beiden Zahlen des Verhältnisses ‚Teile‘ addieren und dann dividieren, dass in 100, wird es geben Sie den Prozentsatz Endverdünnung. Zum Beispiel kann das 1: 4-Verhältnis fügt auf „5“ auf. Fünf unterteilt in 100 gibt Ihnen 20%. Was ist, wenn Sie 10% Salz-Wasser-Lösung wollen? Einfach. Was zwei Verhältnis Nummern (beginnend mit ‚1‘ natürlich) in bis zu 10? Ein plus neun oder 1: 9 Mischungsverhältnis. Ein Teil Master Lösung plus 9 Teile destilliertes Wasser gibt Ihnen eine 10% Salz-Wasser-Lösung.
Hier ist ein Diagramm, das die häufiger verwendeten Verhältnisse zeigen. Verwenden 1 gesättigte Lösung Teil und die entsprechende Anzahl der Takte von Wasser zu erhalten, um die gewünschten Lösungsstärke.


Nun wollen wir eine 10% ige Lösung herzustellen. Wir wissen aus dem vorherigen Schritt, daß ein 1: 9-Verhältnis der gesättigten Lösung zu Wasser, um eine 10% ige Lösung erzeugt. Wir wissen auch, dass wir 500 ml der Lösung werden soll (in diesem Fall), so müssen wir nur noch die Größe der einzelnen „Teil“ berechnen.
Weil wir wissen, dass wir ein 1 verwenden: 9-Verhältnis gibt es 10 „Teile“ sein, aber welche Größe sollte jeder Teil sein? Wenn wir 500 ml um 10 teilen können wir sehen, dass jeder Teil 50 ml sein wird.
So wird zuerst messen wir heraus, 1 „Teil“ von gesättigter Lösung oder 50 ml des Master oder gesättigte Lösung und gießen diese in die zweite Flasche. Als nächstes messen wir 9 „Teile“ von Wasser. Da 9x50 = 450 wissen wir, dass wir 450 ml Wasser in unserem Messbecher benötigen. Gießen Sie diese in die zweite Flasche, Kappe und 10% Kochsalzlösung beschriften.
Schritt 6: Wiederherstellen von überschüssigem Salz

Ich würde dieses wieder mit anderen Salz nicht mischen, vertrauen Sie mir Klumpen bilden. Doch das Salz ist essbar und hat keinen Schaden erlitten.
NICHT ein Idiot. HABEN DIE CHEMIE UND LÖSUNGEN AUS VON KINDERN.