Isotopen und durchschnittliche Atommasse - Video & Lektion Transcript
Wenn Sie ein Glas Wasser trinken, sind Sie eigentlich eine Kombination aus schwerem Wasser und Licht Wasser zu trinken. Was ist der Unterschied? Ist es schädlich? Dieses Video wird die Differenz zwischen den beiden Arten von Wasser und geht ins Detail über die Bedeutung der verschiedenen Isotope von Elementen erklären.
Verschiedene Arten von Äpfeln
Also, was macht sie Äpfel? Sie sind alle biologisch namens ‚Malus domestica.‘ Sie wachsen auf Bäumen. Sie haben Stielen. Die Liste geht weiter. Aber was macht sie anders? Zunächst einmal ist die Crabapple sehr klein, es ist in der Farbe rot, und es schmeckt ziemlich sauer. Für die Zwecke dieser Lektion werden wir ihm eine fiktive Masse von 1 amu geben, die wir die ‚Apfelmasseneinheit‘ nennen, während das Golden Delicious mittelgroß, gelblich gefärbt ist, schmeckt süß, und wir ist das eine Masse von 2 amu geben würde. Schließlich ist die Granny Smith groß, grün und schmeckt sauer. Wir werden diesem Apfel eine Masse von 3 amu geben, so dass es wiegt dreimal so viel wie die Crabapple. Sie sind alle ähnlich, dass sie sind Äpfel, aber sie haben viele verschiedene Eigenschaften. Also, wenn ich Sie fragen, was ist die Masse eines Apfels, was würden Sie sagen? 1 amu? 2? Oder 3 amu? Nun, es hängt alles davon ab, welche Art von Apfel Sie sich beziehen.
Verschiedene Arten von Atomen
Wasserstoff hat drei wichtige Isotope. Denken Sie daran, dass Isotope die gleiche Anzahl an Protonen, aber eine unterschiedliche Anzahl von Neutronen haben. Die häufigste Isotop von Wasserstoff hat nur ein Proton und Null Neutronen. Wenn beide Protonen und Neutronen eine Masse von etwa 1 amu (atomare Masseneinheit) haben, die Masse dieses Atoms würde etwa 1 amu (nur die Masse des Protons) sein. Dieses Isotop von Wasserstoff hat einen besonderen Namen, Protium, und es macht mehr als 99,98% aller Wasserstoffatome.
Protium ist der Hauptisotops in dem Element Wasserstoff.

Die nächste häufigste Isotop Deuterium genannt. Sein Kern enthält ein Proton und ein Neutron, so hat es eine Masse von etwa 2 amu. Es macht weniger als zwei hundertstel Prozent der Bevölkerung von Wasserstoffatomen.
Also, wenn ich Sie fragen würde, was die Masse eines Wasserstoffatoms ist, müssten Sie wissen, welche Isotop ich sprach - Protium, Deuterium oder Tritium.
Obwohl Wasser enthält zwei Wasserstoffisotopen, gibt es nur eine kleine Menge von Deuterium.

Atomares Gewicht
Nun, ich mag Ihre Aufmerksamkeit auf das Periodensystem konzentrieren, genauer gesagt, der Wasserstoffblock in der linken oberen Ecke. Sehen Sie die kleine Zahl unter dem chemischen Symbol? Das ist die durchschnittliche Atommasse (oder das Atomgewicht) genannt. Denken Sie daran, die Einheiten für die Atommasse sind amu (oder atomaren Masseneinheiten). Also, welche Isotop der Masse sehen wir? Protium, Deuterium oder Tritium? Die Antwort ist, alle von ihnen.
Schalte Inhalt
Mehr als 55.000 Stunden in allen wichtigen Themen
KOSTENLOSER Zugriff für 5 Tage,
nur ein Konto erstellen.
Das Atomgewicht des Periodensystems ist, auf der Basis der relativen Häufigkeiten jedes Isotops des Elements berechnet. Es ist wirklich ein gewichteter Durchschnitt aller natürlich vorkommenden Isotope. Also, weil die meisten der Wasserstoff mit einer Masse von 1 amu hat, das Atomgewicht auf dem Periodensystem sein wird, sehr nahe an 1; Da es jedoch ein klein wenig von schwereren Wasserstoffisotopen ist, wird das Gewicht repräsentiert etwas höher als 1 oder 1,0079 amu.
Ein weiteres Beispiel ist Lithium. Es gibt zwei wichtige Isotope von Lithium: Lithium-6, die drei Protonen und drei Neutronen und Lithium-7, die drei Protonen und vier Neutronen hat. Nach dem Periodensystem, das Atomgewicht 6,941 amu. Auf dieser Basis, welche Isotop denken Sie, ist am häufigsten? Lithium-6 oder Lithium-7? Da die Zahl 6,941 viel näher an 7 ist, gibt es wahrscheinlich viel mehr Lithium-7 sein, die in der Natur vorkommt. Denken Sie daran, wie die Äpfel und die Wasserstoffatome, beide Lithiumisotopen werden ähnliche Verhaltensweisen haben. Ihr einziger Unterschied ist ihre Masse.
Das Atomgewicht eines Elements enthält, das Gewicht aller Isotope.
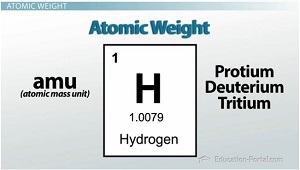
Isotopen sind nur Variationen des gleichen Elements; sie haben die gleiche Anzahl von Protonen, und sie werden alle auf die gleiche Weise reagieren. Der einzige Unterschied ist, dass sie eine unterschiedliche Anzahl von Neutronen, die ihre Massen unterschiedlich machen. Die Fülle an jeder Art von Isotop berücksichtigt wird, wenn die durchschnittliche Atommasse oder das Atomgewicht der Berechnung, die auf der periodischen Tabelle gefunden wird.
Lernerfolg
Nach Ablauf dieser Lektion beobachten, sollten Sie in der Lage sein, zu erkennen, wie Isotope Variationen des gleichen Elements sind, und wie ist das berücksichtigt wird, wenn die Atommasse zu berechnen.
Earning College-Kredit
Wussten Sie schon ... Wir haben mehr als 95 College-Kurse, die Sie Kredit von Prüfung zu verdienen vorbereiten, die von mehr als 2.000 Hochschulen und Universitäten akzeptiert wird. Sie können aus den ersten zwei Jahren College testen und Tausende von Ihrem Grad sparen. Jeder kann Kredit-by-Prüfung unabhängig von Alter oder Bildungsniveau verdient.
Übertragen von Kredit an die Schule Ihrer Wahl
Nicht sicher, welche Hochschule Sie noch teilnehmen möchten? Study.com hat Tausende von Artikeln über jeden erdenklichen Grad, Studienbereich und Karriereweg, dass Sie die Schule helfen können, finden die für Sie richtig ist.
Research Schools, Grad - Karriere
Holen Sie sich die unvoreingenommenen Informationen, die Sie die richtige Schule finden müssen.