JWH-073, wie man
Abstrakt
Ein flüssiges chromatographische Verfahren wurde eine umfassende Reihe von Metaboliten von JWH-018 und JWH-073 zu lösen entwickelt. Neben der chromatographischen Analyseverfahren wurde ein Extraktionsverfahren, ein breites Spektrum an synthetischen Cannabinoid-Metaboliten, einschließlich Carbonsäure-Metaboliten zu erholen entwickelt, die einen hohen pH-Flüssig / Flüssig-Extraktion traditionell nicht zurückgewonnen werden. Die Extraktions- und Analyseverfahren wurden verwendet, um die signifikanten Metaboliten in mehreren authentischen Urinproben zu identifizieren und zu quantifizieren. Neben der Identifizierung von Metaboliten bekannt, zwei bisher nicht dokumentiert wurden Metaboliten nachgewiesen.
Basierend auf den hier gezeigten Daten ist dieses Verfahren geeignet zur Quantifizierung von Metaboliten von JWH-018 und JWH-073 breitere Forschungsstudien zu unterstützen, die positiv klinisch signifikante Metaboliten und die Konzentrationen im Urin identifizieren.
Aufgrund der Terminierung der JWH-018 und JWH-073, Laboratorien werden jetzt mit der Entwicklung von Methoden beauftragt Urin zu analysieren für synthetische Cannabinoide. Die Forschung hat gezeigt, dass die Ausgangsverbindungen werden in großem Umfang vor metabolisiert Ausscheidung und daher vorhanden ist in sehr geringen Mengen in Urinproben [1]. Die reichlichen Metaboliten sind bessere Ziele für Screening-Assays; da jedoch die illegale Verwendung von synthetischen Cannabinoiden ist relativ neu, begrenzte Forschung wurde die genaue Metabolitprofilen bestimmen abgeschlossen.
In früheren Arbeiten wurden mehrere Metaboliten von JWH-018 und JWH-073 sowohl in vivo unter Verwendung identifiziert und in vitro-Studien. Die identifizierten Metaboliten gehören Mono- und Di-hydroxylierten Metaboliten sowie carboxylierten Metaboliten [1,2]. Die hydroxylierten und carboxylierten Metaboliten werden in der Regel separat aufgrund von Unterschieden in pKa-Werte für diese Verbindungen extrahiert. Beide Gruppen von Metaboliten stellen einige chromatographische Herausforderungen; Die hydroxylierten Analyten existiert als multiple Stellungsisomere, die durch MS / MS nicht zu unterscheiden ist, und die carboxylierten Verbindungen sind hydrophil, dass sie schwer mittels RP-HPLC zu erhalten.
Das Ziel dieser Arbeit war es, ein Extraktions- und Analyseverfahren, geeignet zur Identifizierung und Quantifizierung von einer Vielzahl von bekannten und unbekannten synthetischen Cannabinoid-Metaboliten im Urin zu entwickeln. Unser Ziel war es Methodik zu etablieren, die Extraktion vereinfacht und um einen zuverlässigen chromatographische Auflösung von klinisch relevanten Metaboliten.
Experimental
Die Gesamtversuchsanordnung enthielt Kalibratoren in Urin hergestellt wird, auf 7 Ebenen (1, 10, 25, 50, 100, 250 und 500 ng / ml), Rohlinge von 6 getrennten Quellen (3 männlich, 3 weiblich), 2 Qualitätskontrolle (QC ) Proben, die bei 40 ng / ml, und 6 legal erworben authentischen Proben befestigt. Die Quantifizierung und Teil Validierung wurden unter Verwendung dieses Satzes von Proben durchgeführt. Extraktionseffizienz wurde durch einen stärk post-Extraktions Rohling bei 10 ng / ml, und Vergleich der Fläche des erhaltenen Peaks, der den entsprechenden Kalibrator bestimmt, die vor der Extraktion angereichert wurden.
Probenvorbereitung
Urinproben wurden mit synthetischen Cannabinoid-Metaboliten an dem Kalibrator befestigt und QC Ebenen oben definiert ist. Interner Standard-Konzentration betrug 40 ng / ml im Urin für alle Proben, außer der Doppelplatine.
Befestigte und Leerproben wurden durch Zugabe von 1 ml Probe zu 1 ml beta-Glucuronidase aus keyhole limpet (Sigma-Aldrich Kat. # G8132) hydrolysiert und 3 Stunden bei 60 ° C inkubiert. Die Beta-Glucuronidase-Lösung wurde bei 5000 Fishman-Einheiten / ml in 100 mM Ammoniumacetat-Puffer (pH = 5,0) zubereitet.
Hydrolysierten Proben wurden dann extrahiert unter Verwendung von 6 ml, 500 mg C18 Hochlast-endcapped Resprep ® SPE Patronen (Kat. # 24052) gemäß dem folgenden Verfahren. Beachten Sie, dass die Patrone nicht erlaubt werden sollte, bis Schritt 6 trocken zu gehen.
1. 1 ml 5 mM Ammoniumacetat in 0,1% Essigsäure (pH = 4,2) zu hydrolysierten Probe.
2. Bedingung Kartusche mit 3 Spülungen von 1 ml Acetonitril.
3. Bedingung Kartusche mit 3 Spülungen von 1 ml 5 mM Ammoniumacetat in 0,1% Essigsäure.
4. Anwenden Probe Patrone und erlaubt es unter Schwerkraft durchlaufen.
5. Spülen Kartusche mit 3 Portionen von 1 ml 5 mM Ammoniumacetat in 0,1% Essigsäure.
6. Trockenpatrone unter Vakuum für 10 Minuten.
7. Eluieren mit 3 ml Acetonitril, gefolgt von 3 ml Butylchlorid. Man beachte, dass die Verwendung von Butylchlorid nicht notwendig ist, eine ausreichende Rückgewinnungen zu erzielen. Wenn es jedoch verwendet wird, fügen die ersten ml Butylchlorid zu dem letzten ml Acetonitril um die Lösungsmittel zu gewährleisten, vermischt werden.
Probenextrakte wurden bei 40 ° C zur Trockne unter Stickstoff eingedampft und dann in 0,5 ml (50:50) 0,05% Essigsäure in Wasser rekonstituiert: 0,05% Essigsäure in Acetonitril.
Analyse
Das Instrument für diese Analyse wurde ein Shimadzu UFLC XR Flüssigchromatographen gekoppelt an ein AB SCIEX API 4000 LC / MS / MS-Detektor. Gerätebedingungen sind unten, und MRM-Übergänge sind in Tabelle I Hinweis versehen, dass viele der Analyten hier enthaltenen gemeinsame Übergänge teilen. Während Verbindung Optimierung wurden Übergänge anhand von Fülle gewählt sowie Einzigartigkeit, wenn möglich.
Die Quantifizierung wurde unter Verwendung der internen Standards durchgeführt, wie für die Quantifizierung in Tabelle I. Die Wahl des internen Standard angegeben wurde auf der Grundlage sowohl Substanzidentifizierung und die Retentionszeit (zB JWH-073 4-hydroxybutyl quantifiziert wurde mit JWH-018 -pentansäure-d4 anstatt JWH -073 4-Hydroxyindol-d7 aufgrund der Tatsache, dass seine Retentionszeit sehr früh auf den JWH-073 4-Hydroxyindol-d7 internen Standard) verglichen wurde.
LC-Bedingungen
Instrument: Shimadzu UFLC XR
Säule: 5 & mgr; m Ultra-Biphenyl 50 mm x 2,1 mm (Kat. # 9.109.552)
Säulentemperatur: 25 ° C
Mobile Phase A: 0,05% Essigsäure in Wasser (pH ca. 3,4).
Mobile Phase B: 0,05% Essigsäure in Acetonitril
Injektionsvolumen: 10 & mgr; l
Flow: 0,5 ml / min.
MS / MS-Bedingungen
Instrument: API 4000 MS / MS
Ionisations-Modus: ESI +
Datenerfassung Typ: MRM (ungeplante)
Ion Spray Spannung: 3,000V
Quellentemperatur: 600 ° C
Vorhang Gas: 40 psi (275,8 kPa)
Gas 1: 40 psi (275,8 kPa)
Gas 2: 40 psi (275,8 kPa)
CAD Gas: 4 psi (27,6 kPa)
Tabelle I MRM-Übergänge und interne Standards für die Quantifizierung verwendet.
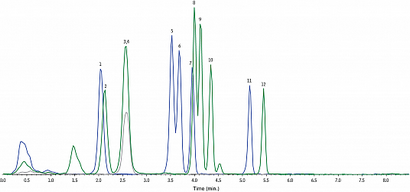
Abbildung 2: 1 ng / ml Kalibrierstandard.
JWH-073 N-butansäure
JWH-018 N-pentansäure
Ultra-Biphenyl (Kat. # 9109552)
50 mm x 2,1 mm ID
50:50 mobile Phase
1 ng / ml Probe extrahiert spiked
Wasser + 0,05% Essigsäure (pH ca.. 3.4)
Acetonitril + 0,05% Essigsäure
Ion Spray Spannung:
40 psi (275,8 kPa)
40 psi (275,8 kPa)
40 psi (275,8 kPa)
Da mehrere Übergänge zwischen Analyten gemeinsam benutzt werden, werden nur Übergänge 3 gezeigten Ansicht zu vereinfachen. Die Übergänge dargestellt sind: 344,1 / 155,1 (blaue Kurve), 358,1 / 155,1 (grüne Linie), 372,1 / 155,2 (graue Kurve). Um zu zeigen, Analyten in Skalenendwert werden interne Standards nicht gezeigt.
CAD Gas wurde auf 4 psi eingestellt.
Für 50 ng / ml Kalibrierpegel finden Chromatogramm LC_CF0531.
Für 500 ng / mL Kalibrierpegel finden Chromatogramm LC_CF0532.
Die Probe wurde nach dem folgenden Verfahren hergestellt:
1) Spike 1 mL leere Harnprobe mit Analyten und internen Standards.
2) Hydrolysieren Beispiel:
- 1 ml-Lösung von Beta-Glucuronidase von Keyhole Limpet (Sigma-Aldrich Kat. # G8132). Lösung wird in einer Konzentration von 5000 Fishman-Einheiten / ml in 100 mM Ammoniumacetat-Puffer (pH = 5,0) zubereitet.
- 3 Stunden bei 60 ° C inkubieren.
3) Extrahieren Probe auf 6 ml, 500 mg C18 Hochlast-endcapped Resprep ® SPE-Kartusche (cat # 24052).:
- 1 ml 5 mM Ammoniumacetat + 0,1% Essigsäure (pH = 4,2) abzutasten.
- Bedingung Kartusche mit 3 x 1 ml Acetonitril.
- Bedingung Kartusche mit 3 x 1 ml 5 mM Ammoniumacetat + 0,1% Essigsäure.
- Anwenden Probe und erlauben, unter Schwerkraft passieren.
- Spülen mit 3 x 1 ml 5 mM Ammoniumacetat + 0,1% Essigsäure.
- Trockenpatrone mit Vakuum für 10 Minuten.
- Eluieren mit 3 ml Acetonitril, gefolgt von 3 ml Butylchlorid.
4) Konzentratprobe:
- Man dampft zur Trockne Probe unter Stickstoff bei 40 ° C.
- Rekonstituieren in 0,5 ml Wasser + 0,05% Essigsäure: Acetonitril + 0,05% Essigsäure (50:50).
Besonderer Dank geht an Cayman Chemical für Referenzstandards
Da mehrere Übergänge zwischen Analyten gemeinsam genutzt werden, sind nur 5 Übergängen gezeigt Betrachtung zu vereinfachen. Die Übergänge dargestellt sind: 344,1 / 155,1 (blaue Kurve), 358,1 / 155,1 (grüne Linie), 372,1 / 155,2 (graue Kurve), 376,1 / 155,2 (lila Spur - interner Standard), 351,3 / 127,0 (rote Spur - interner Standard)
CAD Gas wurde auf 4 psi eingestellt.
Für 1 ng / ml Kalibrierebene siehe Chromatogramm LC_CF0530.
Für 50 ng / ml Kalibrierpegel finden Chromatogramm LC_CF0531.
Die Probe wurde nach dem folgenden Verfahren hergestellt:
1) Spike 1 mL leere Harnprobe mit Analyten und internen Standards.
2) Hydrolysieren Beispiel:
- 1 ml-Lösung von Beta-Glucuronidase von Keyhole Limpet (Sigma-Aldrich Kat. # G8132). Lösung wird in einer Konzentration von 5000 Fishman-Einheiten / ml in 100 mM Ammoniumacetat-Puffer (pH = 5,0) zubereitet.
- 3 Stunden bei 60 ° C inkubieren.
3) Extrahieren Probe auf 6 ml, 500 mg C18 Hochlast-endcapped Resprep ® SPE-Kartusche (cat # 24052).:
- 1 ml 5 mM Ammoniumacetat + 0,1% Essigsäure (pH = 4,2) abzutasten.
- Bedingung Kartusche mit 3 x 1 ml Acetonitril.
- Bedingung Kartusche mit 3 x 1 ml 5 mM Ammoniumacetat + 0,1% Essigsäure.
- Anwenden Probe und erlauben, unter Schwerkraft passieren.
- Spülen mit 3 x 1 ml 5 mM Ammoniumacetat + 0,1% Essigsäure.
- Trockenpatrone mit Vakuum für 10 Minuten.
- Eluieren mit 3 ml Acetonitril, gefolgt von 3 ml Butylchlorid.
4) Konzentratprobe:
- Man dampft zur Trockne Probe unter Stickstoff bei 40 ° C.
- Rekonstituieren in 0,5 ml Wasser + 0,05% Essigsäure: Acetonitril + 0,05% Essigsäure (50:50).
Besonderer Dank geht an Cayman Chemical für Referenzstandards
Teil-Validierungsdaten
Die Leistung des chromatographischen Verfahren basierte auf Signal-zu-Rauschen, Linearität ausgewertet, zurückgerechneten Genauigkeit für Kalibratoren und Ionensuppression Messung (Tabelle II). Adäquate geringe Reaktionen wurden erhalten und eine gute Linearität (r ≥ 0,9982) wurde für alle Metaboliten über einen Mengenbereich von 1 ng / ml bis 500 ng / ml im Urin beobachtet. Vergleich der zurückgerechneten Kalibrator Konzentrationen Vorbereitete Werte zeigten Genauigkeit an beiden Enden des linearen Bereichs für alle Verbindungen erreicht wurde.
Ionenunterdrückung wurde durch Peakflächen Vergleich einer Blindprobe nach der Extraktion mit einem Lösungsmittel versetzt Standard bestimmt. Auf der Grundlage der in diesem Projekt gesammelten Ergebnissen wurde keine Unterdrückung beobachtet, aber signifikante Verbesserung aufgetreten mehrere Analyten.
Störeinflüsse und Verschleppung wurden auch in dieser Studie ausgewertet. Eine Doppelblindprobe wurde unmittelbar nach dem Hoch Kalibrator injiziert und keine Verschleppung oder Störspitzen wurden mit Flächen von mehr als 5% des niedrigen Kalibrators beobachtet. Außerdem 5 weitere Blindproben aus unabhängigen Quellen wurden analysiert und keine Störungen wurden in jeder dieser Proben festgestellt.
Tabelle II. Chromatographieleistung Ergebnisse.
Linearität (r)
(Quant. Ion)
Zurückgerechneten
Genauigkeit
1 ng / ml **
* Signal-Rausch-Verhältnis für alle MRM-Übergänge an der Quantifizierungsgrenze war größer als 10: 1.
** Berichtet Genauigkeit, basierend auf der Quantifizierung Ion betrug 77,9% -119% für alle Kalibratoren und alle Übergänge.
Obwohl Gewinnungsraten für einige Verbindungen waren relativ gering ist, ist die Verwendung einer mittleren pH-Extraktion (pH = 4,2), wie auf eine hohe pH-Extraktion zur Rückgewinnung der Carbonsäure-Metaboliten sowie die mono-Hydroxy-Metaboliten erlaubt gegenüber. Recoveries für klinisch signifikante Metaboliten von 70% bis 78% lag. Bisher veröffentlichte Verfahren beschreiben die Verwendung eines hohen pH-Flüssig / Flüssig-Extraktion bei der Analyse von synthetischen Cannabinoids Metaboliten [1]. Während der Extraktionsmethode von Sobolewski et al. war geeignet für hydroxylierten Metaboliten sind die Einziehungen von carboxylierten Metaboliten bei hohem pH-Wert sehr niedrig. Während eine zweite Flüssigkeit / Flüssigkeit-Extraktion bei niedrigem pH-Wert erforderlich ist, um ausreichend carboxylierten Metaboliten, die SPE-Extraktionsverfahren für diese Analyse ist für beide mono-hydroxylierten und carboxylierten Metaboliten von JWH-018 und JWH-073 geeignet entwickelt zu.
Tabelle III. Absaugleistung Ergebnisse.
Durchschn. Genauigkeit
40 ng / mL QCs
(N = 2) *
Extraction Rettung
(Quant Ion)
10 ng / ml
* Berichtet Genauigkeit für die Quantifizierung Ion.
Authentische Probenanalyse
Nach der Validierung wurden 6 authentischen Proben hergestellt und analysiert nach dem Verfahren hier hergestellt (Tabelle IV). Alle angegebenen Werte erfüllen Ionenverhältnis-Kriterien für den ersten Qualifi MRM Übergang; jedoch sind die meisten Ergebnisse für JWH-018 5-hydroxypentyl entsprachen nicht das Ionenverhältnis Kriterien für das zweite Qualifikationsspiel. Wie in 4 gezeigt, war der Peak für diese Analyten etwas breiter als erwartet. Um festzustellen, ob diese Ergebnisse aufgrund waren koeluierenden Interferenzen, Proben und Kalibratoren wurden erneut analysiert, um eine längere Säule und ein 60-minütigen isokratischen Verfahren. Die Ergebnisse aus den isokratische Analysen ergaben eine koeluierenden Spitze mit den gleichen Übergängen wie JWH-018 5-hydroxypentyl. Dieser Peak war in einem der Leerproben nicht vorhanden ist, und auf der Grundlage dieser Arbeit, ist höchstwahrscheinlich ein nicht dokumentiertes Metaboliten von JWH-018. Basierend auf den letzten Arbeiten von NMS Labs, das unbekannt ist höchstwahrscheinlich JWH-018 4-hydroxypentyl [3]. Chromatographie für die isokratische Methode war nicht geeignet für die Quantifizierung, so dass keine quantitativen Ergebnisse können für diese Verbindung angegeben werden. Ergebnisse für JWH-018 5-hydroxypentyl gezeigt sind die Summe von JWH-018 5-hydroxypentyl und dem unbekannten Metaboliten.
Obwohl JWH-073 n -butansäure in mehreren Proben, keine JWH-073 4-hydroxybutyl nachgewiesen. Ein großer Peak mit den gleichen Übergängen als JWH-073 4-hydroxybutyl war in den authentischen Proben zu einer etwas früheren Retentionszeit als JWH-073 4-Hydroxybutyl. Post-Extraktions Spiking der Probe # 1 mit 2 ng JWH-073 4-hydroxybutyl bestätigt, dass der beobachtete Peak JWH-073 4-hydroxybutyl zurückzuführen war. Der unbekannte Peak wurde nicht in irgendwelchen Leerproben beobachtet, was darauf hindeutet, dass es auch ein unbekannter Metabolit von beiden JWH-018 oder JWH-073 ist. Basierend auf den letzten Arbeiten von NMS Labs, das unbekannt ist wahrscheinlich JWH-073 3-Hydroxybutyl [3]. Das chromatographische Verfahren verwendete hier war ausreichend, um teilweise die unbekannte Verbindung aus dem Standard zu lösen, und der unbekannte Peak wurde JWH-073 4-Hydroxybutyl quantitativ bestimmt werden. Die Ergebnisse für diesen unbekannten Metaboliten sollten semi-quantitative betrachtet werden.
Abbildung 4: authentische Probe # 1.
Mutmaßliche unbekannte Metaboliten
JWH-073 N-butansäure
JWH-018 N-pentansäure
JWH-018 5-hydroxypentyl + unbekannte Metaboliten
Ion Spray Spannung:
40 psi (275,8 kPa)
40 psi (275,8 kPa)
40 psi (275,8 kPa)
Da mehrere Übergänge zwischen Analyten gemeinsam benutzt werden, werden nur Übergänge 3 gezeigten Ansicht zu vereinfachen. Die Übergänge dargestellt sind: 344,1 / 155,1 (blaue Kurve), 358,1 / 155,1 (grüne Linie), 372,1 / 155,2 (graue Kurve). Interne Standards sind nicht gezeigt.
CAD Gas wurde auf 4 psi eingestellt.
Die Probe wurde nach dem folgenden Verfahren hergestellt:
1) Spike 1 mL leere Harnprobe mit Analyten und internen Standards.
2) Hydrolysieren Beispiel:
- 1 ml-Lösung von Beta-Glucuronidase von Keyhole Limpet (Sigma-Aldrich Kat. # G8132). Lösung wird in einer Konzentration von 5000 Fishman-Einheiten / ml in 100 mM Ammoniumacetat-Puffer (pH = 5,0) zubereitet.
- 3 Stunden bei 60 ° C inkubieren.
3) Extrahieren Probe auf 6 ml, 500 mg C18 Hochlast-endcapped Resprep ® SPE-Kartusche (cat # 24052).:
- 1 ml 5 mM Ammoniumacetat + 0,1% Essigsäure (pH = 4,2) abzutasten.
- Bedingung Kartusche mit 3 x 1 ml Acetonitril.
- Bedingung Kartusche mit 3 x 1 ml 5 mM Ammoniumacetat + 0,1% Essigsäure.
- Anwenden Probe und erlauben, unter Schwerkraft passieren.
- Spülen mit 3 x 1 ml 5 mM Ammoniumacetat + 0,1% Essigsäure.
- Trockenpatrone mit Vakuum für 10 Minuten.
- Eluieren mit 3 ml Acetonitril, gefolgt von 3 ml Butylchlorid.
4) Konzentratprobe:
- Man dampft zur Trockne Probe unter Stickstoff bei 40 ° C.
- Rekonstituieren in 0,5 ml Wasser + 0,05% Essigsäure: Acetonitril + 0,05% Essigsäure (50:50).
Besonderer Dank geht an Cayman Chemical für Referenzstandards