Lösung - Körper, verwendet, Wasser, Gas, Kohlenstoff, Sauerstoff, Luft, Ursache
Eine Lösung ist eine homogene Mischung aus zwei oder mehr Substanzen. Der Begriff homogene Mittel # X0022; überall gleich # x0022. Angenommen, dass Sie eine Lösung von Zucker in Wasser zu machen. Wenn Sie von überall in der Lösung einen Tropfen Zuckerlösung zu nehmen, wäre es immer die gleiche Zusammensetzung aufweist.
Terminologie
Eine Reihe von Fachbegriffen sind im Gespräch über Lösungen eingesetzt. Das Lösungsmittel in einer Lösung ist, die Substanz, die das Auflösen der Fall ist. Der gelöste Stoff ist die Substanz, die aufgelöst wird. In der Zuckerlösung, die oben beschrieben ist, ist das Wasser das Lösungsmittel und der Zucker ist der gelöste Stoff.
Obwohl diese Definition ordentlich ist, ist es immer nicht viel Sinn machen. Zum Beispiel kann man eine Lösung von zwei Gasen machen. In der Tat ist die Luft um uns eine Lösung, bestehend aus Sauerstoff, Stickstoff, Argon, Kohlendioxid und anderen Gasen. In diesem Fall ist es schwierig zu sagen, welches Gas # X0022; tut das Auflösen # x0022; und das Gas (oder Gase) # X0022; aufgelöst # x0022.
Ein alternatives Verfahren von Lösungsmitteln und gelösten Stoff definiert, ist zu sagen, dass die Komponente der Lösung, die in der größten Menge die Lösungsmittel, während die Komponenten in geringeren Mengen vorhanden sind gelöster Stoff. Nach dieser Definition ist Stickstoff das Lösungsmittel in atmosphärischer Luft, weil es in der größten Menge vorhanden ist. Sauerstoff, Argon, Kohlendioxid und andere Gase, so sind die gelösten Stoffe.
Worte die man kennen sollte
Konzentration: Die Menge einer Substanz (solute), die in einem gegebenen Volumen des Lösungsmittels oder die Lösung.
Homogen: überall gleich.
Mischbarkeit: Das Ausmaß, in dem einige Substanz mit einer anderen Substanz mischen.
Gesättigte: In Bezug auf den Lösungen, um eine Lösung, die die maximale Menge des gelösten Stoffes für eine gegebene Lösungsmittelmenge bei einer bestimmten Temperatur enthält.
Löslichkeit: Die Tendenz eines Stoffes in einem anderen Stoff zu lösen.
Solute: Die Substanz, die ist # X0022; # x0022 gelöst; oder dass existiert in der geringsten Menge in einer Lösung.
Lösungsmittel: Die Substanz, die # X0022; tut das Auflösen # x0022; oder das existiert in der größten Menge in einer Lösung.
Übersättigte: In Bezug auf die Lösungen eine Lösung, die mehr als die maximale Menge an Lösungsmittel enthält, die normalerweise bei einer bestimmten Temperatur in einer bestimmten Menge Lösungsmittel gelöst werden.
Ungesättigte: In Bezug auf den Lösungen eine Lösung, die weniger als die maximale Menge an Lösungsmitteln enthält, die in einer bestimmten Menge des Lösungsmittels bei einer gegebenen Temperatur aufgelöst werden können.
Löslichkeit ist ein Begriff, ähnlich wie Mischbarkeit aber genauer. Die Löslichkeit eines Stoffes ist die Menge der Substanz, die in einer bestimmten Menge Lösungsmittel auflösen. Zum Beispiel ist die Löslichkeit von Zucker in Wasser etwa 90 Gramm Zucker pro 100 Gramm Wasser. Diese Aussage bedeutet, daß man bis 90 g Zucker in 100 g Wasser lösen kann.
Die Löslichkeit eines Stoffes ist von der Temperatur abhängig. Die Erklärung im vorherigen Absatz zum Beispiel hätte sein sollen, dass 90 Gramm Zucker in 100 Gramm Wasser bei einiger spezifischen Temperatur auflösen. Diese Temperatur geschieht 0 # x00B0 sein; C.
Im Allgemeinen erhöht die Löslichkeit von Substanzen mit der Temperatur. Das Diagramm in Abbildung 1 veranschaulicht diesen Punkt. Beachten Sie, dass die Löslichkeit von Zucker erhöht sich auf etwas mehr als 100 Gramm pro 100 Gramm Wasser bei 25 # x00B0; C und bis 130 Gramm pro 100 Gramm Wasser bei 50 # x00B0; C.
Eine wichtige Ausnahme von dieser Regel betrifft Gas. Alle Gase werden in Wasser weniger löslich als die Temperatur ansteigt.
Die Konzentration der Lösungen
Lösungen sind Mischungen, deren Zusammensetzung kann stark variieren. Man kann durch Lösen von 1 Gramm Natriumchlorid in 100 g Wasser eine Wasserlösung von Natriumchlorid machen; 5 Gramm in 100 Gramm Wasser; 10 Gramm in 100 Gramm Wasser; und so weiter. Die Menge des gelösten Stoffes für jede gegebene Menge an Lösungsmitteln wird als die Konzentration der Lösung definiert.
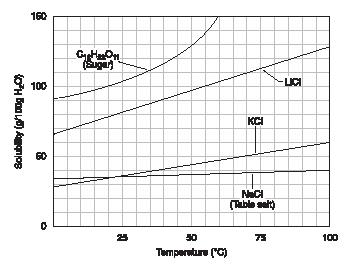
Abbildung 1 (Wiedergabe mit Genehmigung von
Eine Möglichkeit, die Konzentration einer Lösung auszudrücken, ist mit den Begriffen verdünnt und eingeengt. Diese Begriffe sind nicht sehr spezifisch. Beispielsweise 1 Gramm Natriumchlorid-Lösung in 100 g Wasser und eine zweite Lösung, die 2 g Natriumchlorid in 100 g Wasser enthält, ist sowohl verdünnen. Aber der Begriff ist geeignet, da, bei Raumtemperatur, etwa 40 g Natriumchlorid in 100 g Wasser aufgelöst werden. Somit wird eine Lösung, die 35 g Natriumchlorid in 100 g Wasser enthält, kann eine konzentrierte Lösung bezeichnet werden.
Lösungen können auch als gesättigte, ungesättigte oder übersättigten klassifiziert werden. Eine gesättigte Lösung ist eine, die alle gelösten Stoff hält es möglicherweise zu einer gegebenen Temperatur kann. Zum Beispiel ist die Löslichkeit von Natriumchlorid in Wasser 37 Gramm pro 100 Gramm Wasser. Wenn Sie eine Lösung, die 37 g Natriumchlorid in 100 g Wasser machen, wird die Lösung zu dem gesättigt sein; es kann # x0027; t mehr Natriumchlorid halten.
Jede Lösung weniger als die maximal mögliche Menge an gelösten Stoffen enthält, wird gesagt, dass ungesättigt. Eine Lösung mit 5 g Natriumchlorid (oder 10 g oder 20 g oder 30 g) in 100 Gramm Wasser ungesättigt ist.
Schließlich sind übersättigte Lösungen möglich. So bizarr es klingt, ist eine übersättigte Lösung, die mehr gelösten Stoff hält als bei einer gegebenen Temperatur möglich ist. Die Art und Weise eine übersättigte Lösung zu machen, ist eine gesättigte Lösung bei einem etwas höheren Temperatur zu machen und dann die Lösung läßt sehr vorsichtig abkühlen.
Zum Beispiel könnte man eine gesättigte Lösung von Zucker in Wasser bei 50 # x00B0 machen; C durch Zugabe von 130 Gramm Zucker 100 Gramm Wasser. Diese Lösung würde gesättigt sein. Aber dann könnte man die Lösung lassen sich sehr langsam abkühlen. Unter diesen Umständen kann es vorkommen, dass der gesamte Zucker in Lösung, selbst bei einer Temperatur von 25 # x00B0 bleiben würde; C. Aber bei dieser Temperatur ist die Löslichkeit von Zucker normalerweise etwas mehr als 100 Gramm pro 100 Gramm Wasser. Daher wäre die gekühlte übersättigte Lösung werden. Übersättigte Lösungen sind in der Regel sehr instabil. Die geringste Bewegung in der Lösung, wie einfach es rüttelt, kann dazu führen, der überschüssige gelösten Stoff aus der Lösung zu begleichen.
Lesen Sie auch Artikel über Lösung von Wikipedia