Anorganische Industrial Chemistry - Chemie Lexikon - Reaktion, Wasser, Anwendungen, Beispiele, Gas,
Industrielle Anorganische Chemie beinhaltet Unterteilungen der chemischen Industrie, das in großem Maßstab anorganische Produkte herzustellen, wie beispielsweise die schweren anorganischen Substanzen (Chlor Alkalien, Schwefelsäure, Sulfate) und Düngemittel (Kalium, Stickstoff und Phosphor-Produkte) sowie Segmente von Feinchemikalien , die zur Behandlung von hohem Reinheits Anorganika auf einem viel kleineren Maßstab herzustellen. Unter diesen sind Reagenzien und verwendeten Rohstoffe in High-Tech-Industrie, Pharma oder Elektronik, zum Beispiel, sowie bei der Herstellung von anorganischen Spezialitäten wie Katalysatoren, Pigmente und Treibmittel.
Metalle sind Chemikalien, die in einem gewissen Sinne. Sie werden aus Erzen hergestellt und gereinigt durch viele der gleichen Verfahren wie diese bei der Herstellung von anorganischen Stoffen verwendet. Wenn sie jedoch als Legierungen oder in ihrer reinen Form wie Eisen kommerzialisieren, Blei, Kupfer oder Wolfram, werden sie Produkte der metallurgischen keine chemischen Industrie.
Die chemische Industrie
Basischemikalien stellen den Ausgangspunkt für die Herstellung von anorganischen Industriechemikalien. Sie sind in der Regel einen Schritt weg von den Rohstoffen in Tabelle 1 aufgeführt und sind auf einem sehr großen Maßstab unter Verwendung von kontinuierlichen Verfahren hergestellt. Der Stückpreis dieser Produkte ist relativ gering, und sie kostengünstig produzieren und effizient ist ein wichtiges Anliegen für die Unternehmen, die sie produzieren. Schwefel, Stickstoff, Phosphor und Chlor-Alkali-Industrie sind die wichtigsten Hersteller von anorganischen Grundchemikalien, und sie werden sie oft auch auf andere Branchen verkaufen, wie sie bei der Herstellung ihrer eigenen Endprodukte verwenden. Die Grundprinzipien für ihre Herstellung und die wichtigsten Anwendungen sind für jede dieser Branchen hier angegeben.
Anorganische Chemikalien in industriellem Maßstab hergestellt werden, können leicht identifiziert werden. Viele der heute # x0027; s große Unternehmen begann als Hersteller von anorganischen Stoffen,

Anorganische Chemikalien wie Chlor, in dieser Pflanze in Louisiana hergestellt wird, sind bei der Herstellung von mehreren Chloriden, einschließlich PVC und Salzsäure verwendet.
Quellen für Anorganische Rohstoffe
viele verschiedenen Quellen von Rohstoffen für die Herstellung von anorganischen Chemikalien Es gibt (siehe Tabelle 1). Nur sehr wenige von ihnen sind in ihrer elementaren Form gefunden. Schwefel ist eine bemerkenswerte Ausnahme. Es kommt in unterirdischen Lagerstätten und kann durch Druckluft an die Oberfläche gebracht werden, nachdem sie durch Heißdampf geschmolzen wird. Jedoch zunehmende Mengen von Schwefel aus Erdöl und Erdgas gewonnen (wo sie als Verunreinigungen auftreten).
Verwertung und Recycling bieten steigende Mengen einiger Metalle. Als Umweltbelange zu erhöhen, werden wahrscheinlich diese Vorgänge bei der Herstellung von bestimmten anorganischen Chemikalien eine wichtige Quelle für Materialien worden.
Ätznatron, Reinigungsformulierungen
Die Anfänge der chemischen Industrie
Die Ursprünge der chemischen Industrie können zur industriellen Revolution zurückverfolgt werden. Schwefelsäure und Natriumcarbonat wurde unter den ersten Industriechemikalien. # X0022; Vitriolöl # X0022; (Als erstere bekannt war) spielte eine wichtige Rolle bei der Manipulation von Metallen, aber die Produktion im industriellen Maßstab erforderlich, um die Entwicklung von Materialien, die Angriffen widerstehen würde. Natriumcarbonat wurde in seiner wasserfreien Form erhalten wird, # X0022; Soda, # x0022; aus pflanzlichem Material, bis die Mengen nicht mehr produziert könnte die schnell wachsenden Bedürfnisse der Hersteller von Glas, Seife und Textilien erfüllen. Dies führte die Königlichen Akademie der Wissenschaften von Paris, im Jahr 1775, einen Wettbewerb für die Entdeckung eines Prozesses auf einem reichlich vorhandenen Rohstoffe, Natriumchlorid, und Nicolas Leblanc # x0027 zu schaffen; s Methode zur Herstellung von Soda durch Salz Umwandlung in Sulfat
durch die Umwandlung des Sulfats zu Soda, gefolgt mit Kohle und Kreide
Obwohl er nicht den Preis, Leblanc # x0027 gewonnen hat; s Prozess wird mit der Geburt der industriellen Chemie verbunden.
Die industrielle Produktion von Chemikalien wurden in der Regel basierend auf Reaktionen ausgeführt, die die gewünschten Produkte auf viel größeren Skalen zu erhalten waren bekannt. Erfolg bei diesen Bemühungen liegt vielmehr in der Erfahrung und das Können ihrer Praktiker als die Anwendung von festen chemischen Prinzipien. Dies führte zu ernsthaften Problemen der Kontrolle und die Erzeugung von schädlichen Nebenprodukten. Die Einführung des Leblanc Prozesses im Nordwesten von England führte zu einem allgemeinen öffentlichen Aufschrei gegen den dunkelen und ätzenden Rauch, der die umliegende Landschaft bedeckt. Das Alkali Act, im Jahr 1863 als Reaktion geführt, stellt die erste Gesetzgebung, die Emissionsnormen festgelegt.
Schwefelsäure war eine wesentliche Chemikalie für Färber, Bleicher und Alkali Hersteller. Seine Produktion in großem Maßstab erforderlich, um die Entwicklung von Blei ausgekleideten Kammern, die die Dämpfen widerstehen können, die gebildet wurden, wenn Schwefel mit Nitraten verbrannt wurden
Schwefelsäure wurde auch bei der Herstellung von Superphosphaten verwendet, die von der Mitte des neunzehnten Jahrhundert als Düngemittel in großem Maßstab produziert wurden. Zu dieser Zeit wurde eine Lösung für die komplexen technischen Probleme gefunden, die die Verwendung des alternativen Verfahrens behindert hatten Soda zu produzieren
Ernest Solvay, ein belgischer Chemiker, entworfen, einen Turm, in dem Kohlendioxid effizient mit festen Salz umgesetzt. Die Solvay-Prozess hatte enorme Vorteile gegenüber dem Leblanc Prozess: Es ist nicht so viel Abfall und Umweltverschmutzung haben zu erzeugen; Vorprodukte, Sole und Ammoniak, war leicht verfügbar (letzteres von Gaswerk); weniger Kraftstoff verwendet, und kein Schwefel oder Nitrat beteiligt war. Trotz der höheren Kapitalkosten, wurde es schnell angenommen und wurde bald die wichtigste Quelle für Alkali.
Schwefelsäure und Sulfaten
Schwefelsäure ist seit langem die Chemikalie, die in den größten Mengen im Weltmaßstab (siehe Tabelle 2) hergestellt wird. Seine Produktion wird oft in ein Land # x0027 verknüpft; s Stadium der Entwicklung, aufgrund der großen Anzahl von Transformationsprozessen, in denen es verwendet wird.
Schwefelsäure wird aus elementarem Schwefel hergestellt. Mining war die Hauptquelle für dieses Element, die aus sulfidhaltigen Erzen, oder in sehr reiner Form aus unterirdischen Lagerstätten von dem Frasch Verfahren (Injektion von überhitztem Dampf und Luft in den Bohrungen und die Trennung der Mischung erhalten wurden, die an die Oberfläche steigt ). Die groß angelegte Verbrauch von Erdöl und Erdgas hat sich dieses Szenario geändert, da Schwefel als Verunreinigung in den meisten fossilen Brennstoffen auftritt und müssen entfernt werden, bevor die Brennstoffe verarbeitet werden. Diese Brennstoffe sind derzeit die Hauptquelle von Schwefel, und ihre relative Bedeutung neigt dazu, mit strengeren Kontrollen auf die Emissionen zu erhöhen.
Schwefelsäure wird in drei Stufen hergestellt
Da die Reaktion von Schwefeln mit trockenen Luft exotherm ist, muß das Schwefeldioxid abgekühlt werden, um überschüssige Wärme zu entfernen und die Umkehr der Reaktion zu vermeiden.
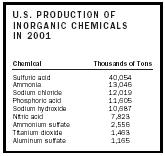
Als eine kostengünstige Quelle für Säure, eine große Menge der Schwefelsäure, die erzeugt wird, wird für die Herstellung von anderen Mineralsäuren eingesetzt. Es wird auch zur Herstellung von Sulfaten, wie Ammoniumsulfat (ein minderwertiges Dünger), Natriumsulfat (verwendet bei der Herstellung von Papier) und Aluminiumsulfat (verwendet in der Wasseraufbereitung), sowie organische Sulfate (verwendet als Tenside ). Schwefelsäure ist auch ein guter Katalysator für viele Reaktionen, einschließlich der Umwandlung von Ethanol zu Ethylen oder Ethylether.
Stickstoffverbindungen
Im allgemeinen Chemikalie Stickstoff enthalten, wird aus Ammoniak nach dem Haber-Bosch-Verfahren hergestellt gefertigt
Der Energieverbrauch ist sehr hoch, und seine Kosten sind ein wichtiger Bestandteil zusammen mit den Ausgangsmaterialien. Stickstoff wird leicht aus der Luft erhalten, und Wasserstoff und kann durch die Shift-Reaktion erzeugt werden,
oder aus Kohlenwasserstoffreformierung
Weitere Stufen sind erforderlich, um sicherzustellen, Umwandlung und Kohlendioxid oder Kohlenmonoxid aus dem Gasgemisch zu entfernen. Ein Gemisch aus Ammoniak und Synthesegas (CO + H 2) ergibt sich aus der Reaktion mit Stickstoff, so müssen die beiden und das Synthesegas zurückgeführt getrennt werden.
Der größte Teil des Ammoniaks, das produziert wird, wird als Dünger verwendet oder verwendet anderen Düngemitteln, wie Harnstoff, Ammoniumsulfat, Ammoniumnitrat, oder Diammoniumhydrogenphosphat herzustellen. Ammoniak wird ebenfalls in der Solvay-Verfahren verwendet, und es ist ein Ausgangsmaterial für die Herstellung von Cyaniden und Nitrile (die Polymere zu bilden werden verwendet, um, wie Nylon und Acryl) sowie aromatische Verbindungen, die Stickstoff enthalten, wie Pyridin und Anilin.
Die andere Quelle von Stickstoffverbindungen in der chemischen Industrie ist Salpetersäure, die aus der Oxidation von Ammoniak gewonnen
4 NH 3 + 5 O 2 # X2192; 4 NO + 6 H 2 O
Die erste Reaktion ist bei etwa 900 # x00B0 über Platin-Rhodium-Katalysatoren läuft; C (1.652 # x00B0; F). In der zweiten und dritten Stufe wird ein Gemisch von Stickstoffoxid und Luft zirkuliert durch Kondensatoren, wo sie teilweise oxidiert wird. Das Stickstoffdioxid wird in einem Turm absorbiert und Salpetersäure sinkt auf den Boden. Salpetersäure wird in erster Linie verwendet, um Ammoniumnitrat zu machen, die meisten davon für Dünger, obwohl es in der Herstellung von Sprengstoffen geht auch. Die Nitrierung wird verwendet, in der Pharma- und Farbstoffindustrie eingesetzt Sprengstoffen wie Nitroglyzerin und Trinitrotoluol (TNT) sowie viele wichtige chemische Zwischenprodukte herzustellen.
Phosphorverbindungen
Welt # x0027; s Hauptphosphorquelle ist Apatit, eine Klasse von Phosphatmineralien. Kommerziell ist die wichtigste Fluorapatit, ein Calciumphosphat, das Fluor enthält. Dieses Fluor muss für die Herstellung von Phosphorsäure entfernt werden, aber es kann auch Flußsäure und fluorierte Verbindungen zur Herstellung verwendet werden.
Phosphorsäure ist das Ausgangsmaterial für die meisten der Phosphate, die industriell hergestellt werden. Es wird aus der Reaktion des Apatitmineral mit Schwefelsäure erhalten
Silica ist in den mineralischen als Verunreinigung, und es reagiert mit Flußsäure Siliciumtetrafluorid zu erhalten, das zu Fluorsäure umgewandelt werden kann, eine wichtige Quelle von Fluor. Mehr als die Hälfte der Phosphorsäure, die direkt durch die Reaktion von Phosphaten mit Schwefelsäure hergestellt wird, um Natrium- oder Ammoniumphosphate umgewandelt wird, um als Dünger verwendet werden; somit Reinheit ist kein Problem.
Phosphorsäure Concentrating führt auf Polyphosphorsäure, ein Gemisch aus mehreren polymeren Spezies, ein guter Katalysator und Dehydratisierungsmittel. Polyphosphatsalze sind als Wasserenthärter in Waschmitteln oder als Puffer in Lebensmitteln verwendet. Geringe Mengen an elementarem Phosphor verwendet werden, Spiele zu machen, und Phosphorhalide Spezialchemikalien für die pharmazeutische und agrochemische Industrie vorzubereiten.
Chlor-Alkali-Verbindungen
2 NaCl + 2 H 2 O # X2192; 2 NaOH + Cl 2 + H 2
Seine Hauptanwendung ist in der Stahlherstellung, aber es geht auch in die Herstellung von Chemikalien, Wasseraufbereitung und Umweltschutz. In dem Solvay-Verfahren, Calciumcarbonat und Natriumchlorid werden verwendet, um Kalziumchlorid und Natriumcarbonat mit Ammoniak erzeugen als Medium (das zurückgeführt wird) zum Lösen und das Natriumchlorid und Calciumhydroxid aus der Lösung zur Ausfällung von Calciumchlorid Carbonisieren.
2 Br # X2212; + Cl & sub2; # X2192; Br 2 + 2Cl # X2212;
Brom wird in der Wasserdesinfektion verwendet wird; Bleich Fasern und Seide; und bei der Herstellung von Arzneimitteln Bromverbindungen und Farbstoffe.
Titanium Dioxide
Titandioxid ist bei weitem die wichtigste Titanverbindung. Es kann in Schwefelsäure gereinigt werden und Ausfällen der Verunreinigungen durch Auflösen. Die Lösung wird dann hydrolysiert, gewaschen und kalzinierten. Alternativ gemahlener Rutil in Gegenwart von Kohlenstoff chloriert und das resultierenden Titantetrachlorid in Sauerstoff verbrannt, um das Chlorid herzustellen.
Anatas, Brookit und Rutil: Titandioxid wird in der Natur in drei Kristallformen gefunden. Ihre extrem Weiße und Helligkeit und der hohe Brechungsindex sind verantwortlich für seine weit verbreitete Verwendung als ein weißes Pigment in Farben, Lacken, Papier, Bodenbelag, Kunststoffe, Gummi, Textilien, Keramik und Kosmetik.
Peter Rudolf Seidl
Carlos Eduardo da Silva Cortes