Chemie Notation Orbital und Lewis Dot - Shmoop Chemie
Da wir Experten herauszufinden, Elektronenkonfiguration sind, wollen wir eine andere Schreibweise Orbital Notation genannt erkunden. In gewissem Sinne ist die Orbital Notation sehr ähnlich zu den Möglichkeiten, wie wir gelernt Elektronenkonfigurationen im vorherigen Abschnitt zu vertreten. Die Wahrheit zu sagen, es ist nur eine alternative Methode, um die Konfiguration in eine Art und Weise zu ziehen, um leicht zu erkennen, wie das Element mit anderen Elementen verbinden kann.
Die Orbital Notation hilft uns herauszufinden, auch das, was wirklich in all diesen verrückten Orbitale vor sich geht. Zum Beispiel, wenn wir die Elektronenkonfiguration siehe „3p 5,“ wir wissen, dass es 5 Elektronen in der p-Unterschale, aber wir wissen nicht, welche Orbitale der Elektronen in tatsächlich befindet. Keine Sorge, bietet die Orbital Notation uns mit dieser Detailebene, die einfach nicht in der Elektronenkonfiguration gefunden werden.
Lass uns anfangen. Zunächst müssen wir die Elektronenkonfiguration eines Atoms tun. Will Silizium als Beispiel benutzen? Wir hoffen es.
Probe Problem
Silizium
1s 2 2s 2 2p 6 3s 2 3p 2
Lassen Sie uns zunächst Rückruf:
• s Subshells haben 1 Orbital
• p Subshells haben 3-Orbitale
• d Subshells haben 5-Orbitale
• f Subshells haben 7 Orbitale
Als nächstes werden wir in den Elektronen als Pfeile dargestellt füllen. Nicht Hunds Regel vergessen, wenn in Ihren Elektronen füllen. Denken Sie daran, dass die stabilste Anordnung für Elektronen in jedem Subshell ist derjenige mit der größten Anzahl von Spins parallel, so werden wir Elektronen gleichmäßig auf Orbitale mit einem gegebenen ersten Subshell verteilen, bevor eine Paarung auftritt. Mit anderen Worten, wird jeder Kreis einen Pfeil vor jedem Kreis zwei Pfeile bekommt.
Es gibt zwei weitere Möglichkeiten, wie wir die Orbital Notation dargestellt sehen könnten:
2) Wo die Orbitale sind als Kreise dargestellt und die Elektronen werden als Schrägstriche dargestellt.
Lewis Punktnotation
Es gibt eine andere spezielle und gemeinsame Notation in der Chemie, die wir meistern werden: Lewis Punktnotation.
Jetzt präsentiert, direkt von Berkley, Kalifornien: Lewis und seinen erstaunlichen Punkten. Lewis Punktnotation wurde zuerst von Gilbert Newton Lewis im Jahr 1916 in einem Artikel mit dem Titel „Das Atom und das Molekül“, veröffentlicht in der Zeitschrift der American Chemical Society vorgestellt.

Das wird einfach suchen. Das ist, weil es ist einfach; Dank der guten ol‘Gilbert. Lewis war die erste Person, die wir wissen, dass dies getan zu haben und es einfach für den Rest von uns so offensichtlich zu machen. Gute Arbeit, Lewis.
Diese Notation ist nur eine andere Art und Weise Details zu zeigen, etwa eines Atoms Wertigkeit (äußeren) Schale. Im Gegensatz zu der Elektronenkonfiguration, die alle Elektronen enthält ein Atom zu bieten hat, sind Lewis-Punkte nur mit Elektronen in der äußersten Schale eines Atoms. Dies bedeutet, dass unabhängig davon, wie viele Elektronen ein Element enthält, werden Lewis Punkte nie als acht höhere Zahl. Wenn es hilft, nur daran erinnern, dass die Super-Hip-TV-Show von 1977 Acht genug ist.
Lassen Sie uns auf Silizium als Beispiel zurückgehen. Wir haben gelernt, bereits die Elektronenkonfiguration des Siliziums 1s 2 2s 2 2p 6 3s 2 3p 2. Die erste ist (n = 1) und zweiten (n = 2) Schalen vollständig gefüllt sind. Die dritte (n = 3) Schale hat ein gefüllte s-Orbital, aber es ist p und d-Orbitale bleibt leer. Deshalb ist die dritte Schale ist unsere Valenzschale und die Elektronen in dieser Schale sind die Valenzelektronen.
Die Lewis-Punkt-Notation besteht aus dem Kern (Nukleus und alle ihre inneren Elektronen, die durch das elementare Symbol dargestellt wird) durch Punkte dargestellt und die Valenzelektronen. Überprüfen Sie die lewis Punktstruktur von Kohlenstoff aus der folgende Liste:
Der Buchstabe „C“ ist der Kern, und wie gesagt bedeutet dies das Atom und seine Innenschale Elektronen (1s 2 Elektronen). Die übrigen vier Valenzelektronen sind um den Kern nach bestimmten Regeln gesetzt. Kümmere dich nicht um nur noch die Regeln. Wir werden bald zu ihnen. Jede der vier Seiten um das elementare Symbol stellt eine der Orbitale in der äußeren Schale. Hier sind die Regeln:
Regel 1. Keine Seite kann mehr als zwei Punkte haben, weil jeder Orbital nur zwei Elektronen aufnehmen kann.
Regel # 2. Wenn die Seiten des Elementsymbol Füllung erhält jeder Seite einen Punkt vor Verdoppelung ... das ist Hunds Regel, nicht unsere. Die Ausnahmen von dieser Regel sind Wasserstoff und Helium, da ihre äußeren Schalen nur zwei Elektronen aufnehmen können. Jedes andere Element gehorcht die zweite Regel.
Wie viele Punkte sollten wir setzen um jedes Element? Die Antwort ist überraschend einfach. Werfen Sie einen Blick auf die periodische Tabelle unten. Denken Sie daran, wie jeder Punkt soll die Anzahl der Elektronen, die in den Elementen äußeren Schale vertreten? Nun, das Periodensystem zeigt die Elemente in einer Art und Weise für uns zu leicht zu bestimmen, wie viele Elektronen in ihrer äußeren Schale.
Die Spalte, in der das Element befindet, wird uns sagen, wie viele Valenzelektronen jedes Element in seiner äußeren Schale hat. Denken Sie daran, Wasserstoff und Helium können nur maximal 2 Valenzelektronen haben in ihrer äußeren Schale, so dass sie die Ausnahmen von der Regel sind.
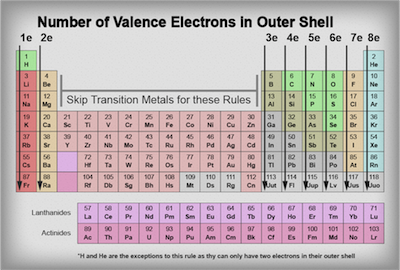
Lassen Sie uns einige Beispiele sehen:
Denken Sie daran, spielt es keine Rolle, wo wir unseren Punkt zuerst um das Element setzen. So stellen Sie sicher, dass Sie eine Seite wählen und dann starten Sie Ihre Punkte in das Hinzufügen entweder im Uhrzeigersinn oder gegen den Uhrzeigersinn Art und Weise um das Element. In dem obigen Beispiel haben wir uns auf der rechten Seite des Elements zu starten und dann das Element geht um in Punkten im Uhrzeigersinn zu füllen.
Bitte beachten Sie dieses Video für eine Anleitung, wie man richtig Ihre Elemente auf „Punkt“.
Bewegen auf Zeichnung Lewis Punktstrukturen verschiedener Verbindungen:
Schritt 1: Zähle die Anzahl der Valenzelektronen in der Verbindung. Verwenden Sie das Periodensystem, um herauszufinden, wie viele Valenzelektronen jedes einzelne Element der Verbindung beiträgt fügen sie dann alle auf. Nehmen Sie H 2 O zum Beispiel. Jedes Wasserstoffatom trägt 2 Valenzelektronen und das Sauerstoffatom trägt 6 ... für eine Gesamtsumme von 8 Valenzelektronen.
Schritt 2. Wenn wir mit einem mehratomigen Ion mit einer negativen Ladung (CO 3 2-), fügen Sie die erforderlichen Elektronen zu tun für die Ladung 1 zu Konto Schritt. Für (CO 3 2-) würden wir zwei weitere Elektronen oder Punkte hinzugefügt werden, da jedes Elektron an eine Einheit der negativen Ladung gleich ist. Alternativ, wenn die mehratomigen Ion mit einer positiven Ladung (NH4 +) hat, subtrahiert die erforderlichen Elektronen für die positive Ladung 1 bis Konto Schritt. Für (NH4 +), würden wir ein Elektron subtrahieren.
Schritt 3. Zeichnet die Skelettstruktur des Moleküls durch eine Linie platzieren (was zwei Elektronen gemeinsam) zwischen jedem Paar von gebundenen Atomen. Beispiel: H-Cl.
Wenn das Molekül in der Regel in der zentralen Lage sein wird, mehr als 2 Atom, die die am wenigsten elektronegativen Atom enthält. Im Allgemeinen Elektronegativität nimmt von rechts auf das Periodensystem links (mit Ausnahme der Edelgase ... sie sind perfekt, so wie sie sind). Zum Beispiel ist Kohlenstoff weniger elektro als Sauerstoff. Für den (CO3 2-) -Molekül, würde das zentrale Kohlenstoffatom sein. Im Folgenden gibt es Beispiele, die visuellen helfen wird, falls zu sehen.
Schritt 4. Weiter, um die Atome in der Weise anordnen, wo die umgebenden Atome eine vollständige äußere Hülle von Elektronen jeweils.
Schritt 5: Schließlich die verbleibenden Elektronen an das Zentralatom hinzuzufügen.
Im Olympischen Tauchen, hoffen Taucher für einen perfekten 10. Mit den äußeren Schalen der Valenzelektronen, die perfekte Punktzahl 8 ist.
Zeichnung Strukturen Lewis Punkt ist einfach, nachdem Sie praktiziert haben.
Probe Problem
Zeichnen Sie die Lewis Strukturformel für CH4 O.
Hinweis: Beachten Sie, dass Wasserstoff und Helium können nur maximal 2 Elektronen in ihrer äußeren Schale.
Die Gesamtzahl der Valenzelektronen in dieser Verbindung sind:
Kohlenstoff (4 Valenz e -) + vier Wasserstoff (4 x 1 Valenz e -) + Sauerstoff (6 Valenz e -) = 14 Gesamt Valenzelektronen
Kohlenstoff ist weniger elektronegativ ist als Sauerstoff, so wird Kohlenstoff unser Zentralatom sein. Die einzelne Lewis Punktstruktur für jedes Atom wie folgt aussieht:
Wenn wir unsere Regeln folgen, finden wir, dass der einzige Weg, eine akzeptable Lewis Punktstruktur gezogen werden kann, wenn Kohlenstoff Aktien Elektronen mit 3 der Wasserstoffatome und die einzelnen Sauerstoffatom. Der übrig gebliebene Wasserstoff wird mit dem Sauerstoff ein Elektronenpaar zu teilen.
Dass sie alle zusammen, lassen Sie uns die einzelnen Elemente und ihre Lewis Punkten um das zentrale Kohlenstoffatom arrangieren:
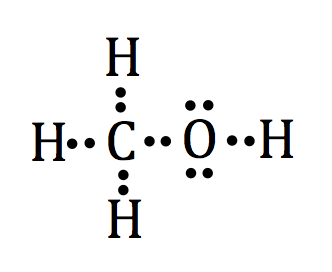
Oder wir verwenden eine einzige Zeile ein Elektron Bindungspaar zwischen den Sharing-Atome wie folgt aussehen darzustellen:
Stellen Sie sich die Elektronen immer noch da auf beiden Seiten der Linie (gestrichelte Kreis) sind, aber jetzt ist die Linie selbst repräsentiert die gemeinsamen Elektronen. Nur um sicher zu sein, können wir die Gesamtzahl der Valenzelektronen zählen, um sicherzustellen, dass es auf die 14 aufaddiert wir oben berechnet.
Die endgültige Lewis Punktstruktur für CH4 O würde wie folgt aussehen:
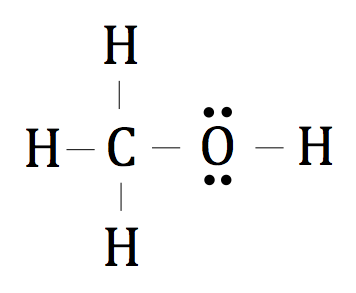
Nun wollen wir versuchen, die Elektronenpunktstruktur eines mehratomigen Ionen-Zeichnung, wie CO3 2-.
So ist die Gesamtzahl der Valenzelektronen in dieser Verbindung sind:
Kohlenstoff (4 Valenz e -) + drei Sauerstoff (3 × 6 Valenz e -) + 2 extra e - (zur Berücksichtigung für die negative Ladung 2) = 24 Gesamt Valenzelektronen
Da wiederum Kohlenstoff weniger elektronegativ als Sauerstoff ist, wird Kohlenstoff unser Zentralatom, die von den drei Sauerstoffatomen umgeben sein.
Die lewis Punktstrukturen jeden einzelnen Atoms gezogen als:
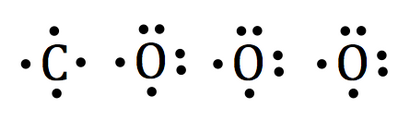
Die drei Sauerstoffatome wird das Kohlenstoffatom sein umgibt.
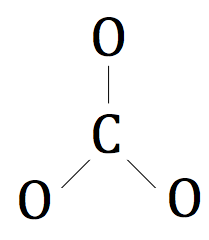
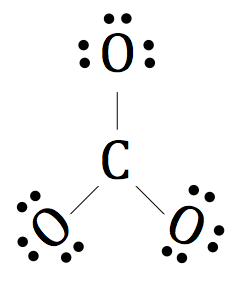
Nun wollen wir die restlichen Valenzelektronen um die Sauerstoffatome ziehen.
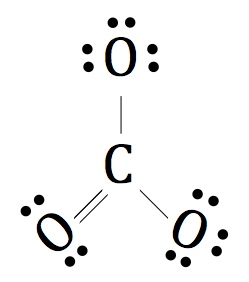
Da es ein mehratomiges Ion ist, legen wir eine Klammer um die gesamte Struktur und die Ladung des negativen zwei nach außen für die vollständige und endgültige Lewis Dot Notation von 2- CO3 hinzuzufügen.
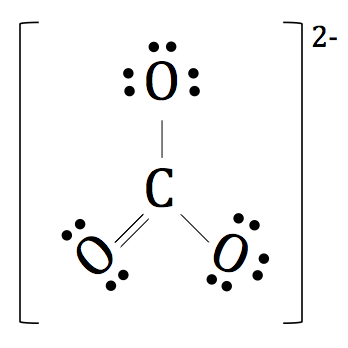
All das Gerede über den Austausch von Elektronen zwischen den Elementen machen uns Ihren Namen Bond ändern möchten.