Formale Ladung und Lewis Structure
Lernziel
Berechnen formale Ladungen auf Atom in einer Verbindung
Wichtige Punkte
- Lewis-Strukturen. auch Lewis Punktdiagramme, Modell kovalente Bindung zwischen den Atomen genannt. Diese Diagramme verwenden Punkten um Atome und Elektronen Linien zu bedeuten Bindungen zwischen Atomen bedeuten.
- Lewis Strukturen beinhalten eine formale Ladung des Atoms. die die Ladung auf einem Atom in einem Molekül ist. unter der Annahme, daß die Elektronen in einer chemischen Bindung zwischen Atomen ebenso gemeinsam benutzt werden.
- Wenn mehrere Lewis-Strukturen können die gleiche Verbindung darstellen. die verschiedenen Lewis Formeln sind Resonanzstrukturen genannt.
Ein Molekül oder Ion, die mehrere mehratomige Lewis-Strukturen aufweisen, da Bond mehr Möglichkeiten gezeigt werden.
Atome verlieren, gewinnen, oder teilen Elektronen, um eine volle Valenzschale von acht Elektronen zu haben.
Die Ladung an ein Atom in einem Molekül zugeordnet ist, unter der Annahme, daß die Elektronen in einer chemischen Bindung zwischen Atomen ebenso gemeinsam benutzt werden. Dies hilft, festzustellen, welche von einigen Lewis-Strukturen ist sehr korrekt.
Lewis Structures
Die Lewis-Punktstruktur aus Kohlenstoff
Eine typische Lewis-Struktur von Kohlenstoff, mit den Valenzelektronen bezeichnet als Punkte um das Atom.
Zeichnen einer Lewis-Struktur
Um eine Lewis-Struktur, die Anzahl der Valenzelektronen auf jedes Atom in der Verbindung zu ziehen muss bestimmt werden. Die Gesamtzahl der Valenzelektronen in der gesamten Verbindung zu der Summe der Valenzelektronen jeden Atoms in der Verbindung gleich. Nicht Valenzelektronen sind nicht dargestellt, wenn die Strukturen Lewis Zeichnung.
Zum Beispiel ist CO2 ein neutrales Molekül mit 16 insgesamt Valenzelektronen. In der Lewis-Struktur sollte, Kohlenstoff zu beiden Sauerstoffatom mit Doppelbindung.
Die Lewis-Struktur für Kohlendioxid
Dieses Diagramm zeigt die konzeptionellen Stufen der Lewis-Struktur für ein Molekül von Kohlendioxid Zeichnung (CO2).
Lewis-Strukturen können auch für Ionen gezogen werden. In diesen Fällen wird die gesamte Struktur in Klammern gesetzt, und die Ladung wird als Exponent auf der oberen rechten geschrieben, außerhalb der Halterung.
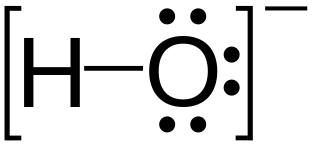
Die Lewis-Struktur für das Hydroxidion
In dem Hydroxidion (OH -), wird die gesamte Struktur von einem Bügel umgeben ist, und die Ladung wird außerhalb der Halterung angeordnet.
Bestimmen formale Ladung
Obwohl wir wissen, wie viele Valenzelektronen in einer Verbindung vorhanden sind, ist es schwieriger zu bestimmen, um welche die Elektronen befinden Atome tatsächlich. Um dieses Problem zu helfen, berechnen Chemiker oft die formale Ladung eines jeden Atoms. Die formale Ladung ist die elektrische Ladung ein Atom hätte, wenn alle Elektronen gleichmäßig verteilt wurden.
Die formale Ladung eines Atoms kann durch die folgende Formel bestimmt werden:
In dieser Formel ist V die Anzahl der Valenzelektronen des Atoms in Isolation darstellt, N die Anzahl der nicht-bindenden Valenzelektronen, und B die Gesamtzahl der Elektronen in kovalente Bindungen mit anderen Atomen im Molekül.
Zum Beispiel wollen wir die formale Ladung an ein Sauerstoffatom in einem Kohlendioxid (CO 2) -Molekül berechnen:
FC = 6 Valenzelektronen - (4 nicht-bindende Valenzelektronen + 4/2 Elektronen in kovalente Bindungen)
Das Sauerstoffatom in Kohlendioxid hat eine formale Ladung von 0.
Resonanzstrukturen
Resonanzstrukturen
Zwei der beitragenden Strukturen von Stickstoffdioxid (NO2). Beiden Formeln repräsentieren die gleiche Anzahl von Atomen und Elektronen, nur in einer etwas anderen Konformation.