Cyclohexan Konformationsanalyse
Cyclohexane Konformationen und Energien
INHALT DIESES KAPITEL
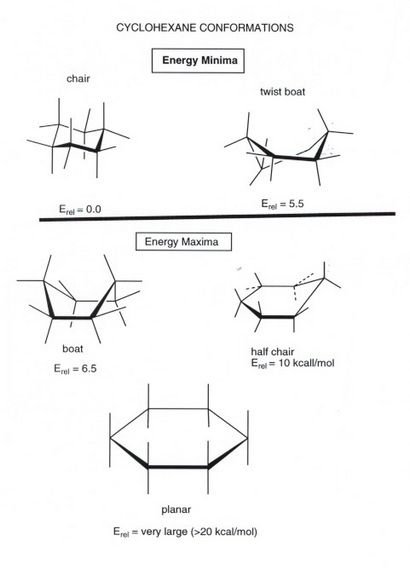
- Die einfachste vorstellbare Konformation für Cyclohexan, die planare eines, nicht nur nicht der Grundzustand Konformation, es so hoher Energie ist, dass es nicht an der Konformationsanalyse Cyclohexan .Diese spielt, ist vor allem wegen der großen Menge von Torsionsspannung der ist in dieser Form vor. Somit sind alle sechs C-C-Bindungen in der ebenen Form sind verdunkelt, so dass wir grob die Torsionsspannung als mindestens 6-mal ist, dass in ekliptischer ethan schätzen könnte, die eine verdunkelte C-C-Bindung aufweist, oder 18 kcal / mol.
- Der Grundzustand Konformation Cyclohexan ist eine vollständig versetzte Konformation, die etwas geformt ist wie ein „Stuhl“. In dieser Konformation ist es nicht bei allen Torsionsspannung, und wie wir später sehen werden, keine Belastung jeglicher Art. Cyclohexan ist einzigartig in der nur cyclischer Kohlenwasserstoff ist, der vollständig spannungsfrei ist. So ist der sechsgliedriger Ring ist die stabilste von all.So wir sehen, dass Torsionseffekten, obwohl individuell klein (pro C-C-Bindung), einen enorm wichtigen Einfluss auf die Formen von Molekülen ausüben und Formen oft Reaktivität bewirken.
- In der Sessel-Konformation sind vier Kohlenstoffatomen coplanar, und die anderen beiden sind aus dieser Ebene verzogenen, oberhalb dieser Ebene (der Kohlenstoff an der äußersten rechten Seite des dargestellten Sesselform) bis verzogen wird und von denen eine faltige nach unten aus diesem heraus wird Ebene (die am äußersten von der Abbildung links). Eine weitere, die Konformation wichtig, in jedem Konformationsanalyse ist, ist der Übergangszustand oder maximale Energie Konformation auf der Dreh path.For Cyclohexan ist dies die sogenannte „Halb-Sessel-Konformation“, in der nun 5 Kohlenstoffatomen co-planar ist, und erst man aus der Ebene gerunzelt. In der Abbildung oben, von der Konformation Stuhl ausgehend, der Halbstuhl dargestellt Form ergibt sich aus den links meisten Kohlenstoff der Sesselform bewegt. welches puckered nach unten, nach oben in die Ebene der vier koplanaren Atom. Dies führt zu großer Torsionsspannung, besonders um die zwei Kohlenstoff-Kohlenstoff-Bindungen, die am weitesten links stehende Kohlenstoff beinhalten. Die Energie dieser Konformation ist etwa 10 kcal / mol. Die Bedeutung hiervon ist, daß in allen Konformationsänderungen in Cyclohexan, 10 kcal die Energiebarriere ist, und der Weg für eine solche Konformationsänderungen muß diese relativ hohe Energie conformation.Because gehen durch diese Barriere so viel größer ist als die in Ethan oder Butan, Cyclohexan Konformationsänderungen können „eingefroren“ werden, zB -78 Grad. Allerdings sind sie bei oder nahe bei Raumtemperatur schnell. Für alle praktischen Zwecke ist nur die Sesselform gefüllt.
- Es gibt, wie im Fall von Butan, eine anderen Energieminimumstruktur, die zu einem gewissen Grad aufgefüllt werden kann. Dies ist die so genannte „Twist Boot“ Konformation bezeichnet. Da jedoch diese Konformation 5,5 kcal / mol energetisch höher ist als der Sessel-Konformation, es ist nicht ein stark bevölkerten state.Again, die meisten der Verformungsenergie ergibt sich aus Bindungen, die verdunkelt werden oder teilweise verdunkelt, das heißt von Torsionsspannung.
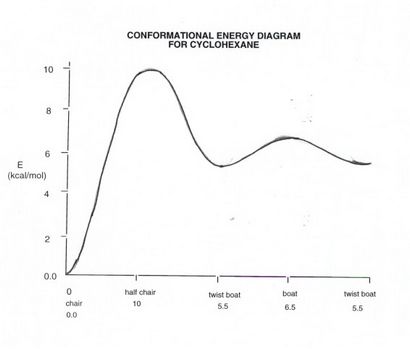
CYCLOHEXANS Konformationsenergie SCHEMA
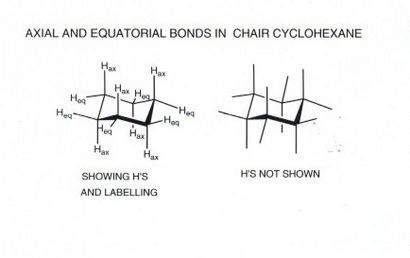
- Beachten Sie, dass die im Stuhl Cyclohexan, gibt es zwei verschiedene Arten von C-H-Bindungen und damit zwei chemisch verschiedene Arten von Wasserstoff. Die C-H-Bindungen, die sie vertikal nach oben gerichtet oder nach unten gerichteten axialer genannt. Es gibt 6 dieser, 3 nach oben und nach unten gerichteten Bindungen 3 und sie abwechselnd nach oben / unten / oben usw. rund um den Ring. Die anderen sechs Bindungen, die sie von dem „Äquators“ des Rings abstrahlen äquatorial genannt, und auch hier gibt es sechs, von denen 3 „schräg nach oben“ und 3 von whicdh sind „schräg nach unten“, wieder um den Ring herum abwechseln.
Sie sollten schnell sein können, Cyclohexanringe, in denen ziehen die axialen und äquatorialen Bindungen leicht erkennbar und unterscheidbar sind.
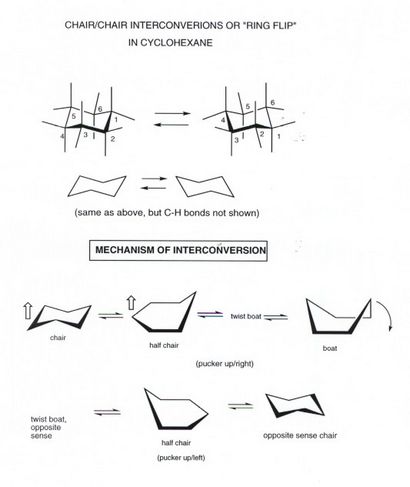
STUHL / STUHL gegenseitige Umwandlung ODER RING FLIP
- Bis jetzt haben wir nicht den Drehweg von Cyclohexan im Detail beschrieben und was ist das Endergebnis. Wir verstehen, dass der beste Weg (der niedrigste Energiepfad) verfügbar verläuft über die Hälfte Stuhl und erfordert eine Energiezufuhr von 10 kcal / mol. Dieser Übergangszustand geht weiter zu einem Energieminimum Twist Boots, aber das ist nicht sehr popupulated und spielt im Allgemeinen wenig oder keine Rolle in Cyclohexan der Struktur oder Chemie. Jedoch kann die Verdrillung Boot mit einem anderen gleichwertigen Drall Boot (über die wahre Bootkonformation als ein Übergangszustand) ineinander umwandeln weiteren Stuhl-Struktur zu geben, bei dem der Sinn der sich zusammenziehenden Ring umgekehrt ist. Dies ist von Bedeutung in Cyclohexan selbst, da bei diesem Verfahren die axialen und äquatorialen interconverted.Since Wasserstoffe dieses gegenseitige Umwandlung oder Ring Flip sind occrus schnell bei Raumtemperatur, werden alle Wasserstoffatome 50% ihrer Zeit damit verbringen, als axiale Wasserstoffe und 50% ihrer Zeit als äquatoriale Wasserstoffatome, so dass im zeitlichen Mittel alle CH-Bindungen von Cyclohexan äquivalent. Allerdings zu einem gegebenen Zeitpunkt gibt es immer zwei Arten von Wasserstoff.
Methylcyclohexan Konformationen
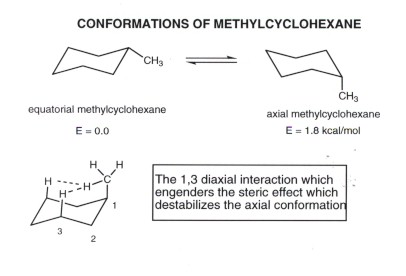
- Da axiale und äquatoriale Bindungen nicht äquivalent sind, sind zwei nicht-äquivalente Positionen, in denen jeden Substituenten zu platzieren. Wir verwenden die einfache Methylgruppe als Beispiel, aber das gleiche Konzept gilt für einen beliebigen Substituenten.
- Äquatorialen Methylcyclohexan ist die stabilere Konformation. Wenn der Ring Flip auftritt, jedoch wandelt es Methylcyclohexan axial. Diese beiden Konformationen sind in einem schnellen Gleichgewicht bei Raumtemperatur, können aber als getrennte Verbindungen bei -78degrees eingefroren werden.
- Die äquatoriale conofrmation ist im Gleichgewicht mit einer geringen Menge bevorzugt, weil die axialen Isomer etwa 1,8 kcal / mol sterischer Spannung aufweist. Dieser Stamm ergibt sich aus der Wechselwirkung von einem des Wasserstoff der Methylgruppe axial mit jedem der beiden anderen axialen Wasserstoff auf der gleichen Seite des Rings, wie oben dargestellt. Jede dieser sterischen interacgions entspricht ungefähr eine gauche Butan Wechselwirkung von 0,9 kcal / mol, so dass die Gesamt beträgt 1,8 kcal / mol. Der Punkt des gauche Butan Vergleichs ist, daß der H / H Abstand der sterisch gehinderten Wasserstoff ist fast genau das gleiche in gauche Butan als mit axialem Methylcyclohexan, mit der Ausnahme, dass es zwei solche H / H-Wechselwirkungen im letzteren Fall.
- Die sterischen Wechselwirkungen in axialer Methylcyclohexan, werden als „1,3-diaxiale Wechselwirkungen“, da die Wechselwirkungen zwei axialen Atome oder Gruppen beinhalten (eine H und eine CH3, und die Kohlenstoffe diese Atome oder Gruppen tragen, sind 1,3 verwandt.
- DIE „EQUATORIALITY PRINZIP“, DASS JEDER Substituenten bevorzugt die LESS Sterisch gehinderte EQUATORIAL Position einzunehmen, WENN ÜBERHAUPT POSSIBLE.IN DEN FALL von bi- oder polysubstituiert Cyclohexane NICHT ALLE SUBSTITUENTEN ALLE äquatorial IN EVERY ISOMER OCCUPY, aber das ISOMER WIRD STABLE DIE IN DENEN alle Substituenten äquatorial OCCUPY (siehe Beispiele unten).
disubstituierte Cyclohexane
1,4-Dimethylcyclohexan
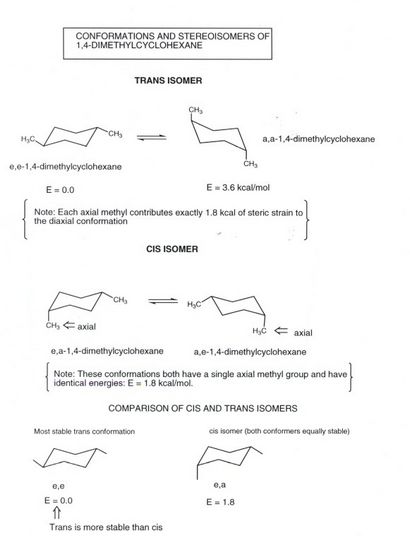
- Beachten Sie, dass mit dem 1,4-Disubstitution Muster, das diäquatoriale (mosts stable) Anordnung ist das, was wir die „trans“ Isomer nennen. darin, ein Substituent „schräg nach oben“ und eine „schräg nach unten“. Ring Umklappen ergibt eine Konformation in der die Methylsubstituenten anti sind (Diederwinkel von 180) miteinander, aber das ist immer noch trans. und thisconformation ist weniger stabil, weil es zwei axiale Substituenten aufweist.
- Es gibt ein anderes Isomer von 1,4-Dimethylcyclohexan, die cis-Isomer. Es sei daran erinnert, dass die cis- und trans-Isomeren sind Diastereoisomere, sind sie nicht verschiedene Konformationen des gleichen Isomers und nicht ohne weiteres durch einen einfachen Drehvorgang ineinander umgewandelt werden (eine Bindung müßte gebrochen werden) .In die cis-Isomer, hier eine Methylgruppe ist äquatoriale und einen axialen und Spiegeln Ring gibt einfach eine andere gleichwertige Konformation. Da ein Methyl axial ist, kostet dies 1,8 kcal der sterischen Belastung. Folglich ist die cis-Isomer thermodynamisch weniger stabil als das trans, die keine sterische Spannung in der stabileren Konformation hat. Die Energiedifferenz ist wiederum 1,8 kcal / mol.
- In der cis-Isomer, ein Substituenten vertikal nach oben (oder nach unten) und der anderen schräg nach oben (oder nach unten). So sie beide Punkt, in einem allgemeinen Sinne, in der gleichen Richtung, das heißt sowohl nach oben oder beide nach unten.
1,3-Dimethylcyclohexan

- In der 1,3-Disubstitution Muster (ob es Dimethyl- oder andere 1,3-dibsubstitution ist), können die beiden Gruppen nur äquatorial sein, wenn sie beide cis sind. So die cis-Isomer ist das stabilere Isomer in diesem Fall. Ring Flipping gibt eine Konformation der cis-Isomeren, die axialen beiden Methylgruppen aufweist. Schlimmer noch, sie beide auf der gleichen Seite des Rings befinden, es ist also keine axiale Methyl / Wasserstoff axiale Wechselwirkung mehr, ist es eine axiale methy / axial Methyl Wechselwirkung, die sterisch ist viel schlimmer. Folglich ist dieser Ring Flip ist auch energetisch schwierig, und diese Konformer können in ihm Konformationsanalyse vernachlässigt werden.
- Die trans-1,3-Dimethylcyclohexan-Isomer. auf der anderen Seite hat eine Methyl axial in beide Ring-Flip-Konformere, so dass es sich um 1,8 kcal / mol weniger stabil als die cis-Isomer ist.
- Sowohl trans-1,4-Dimethylcyclohexan und cis-1,3-Dimethylcyclohexan haben im wesentlichen die gleiche Energie, da keiner von ihnen jeden Stamm überhaupt hat.

Das 1,2-Disubstitution Muster ist sehr ähnlich wie das 1,4-Muster in, dass die beiden Gruppen nur äquatorialen sein, wenn sie trans sind, so das trans-Isomer ist stabiler als die cis. Der diaxiale trans-Konformer hat 3,6 kcal sterische Belastung, natürlich und ist viel weniger begünstigt als der diäquatoriale Konformer.
Die cis-Isomer ist weniger stabil als die trans weil in ihm, eine Methyl axialer sein muß. Die cis-Isomer ist daher weniger stabil als die von 1,8 kcal trans.
Der Hauptunterschied zwischen dem 1,2- und 1,4-Muster ist, das in der diäquatoriale 1,2 Konformation sind die Methylgruppen gauche wie in gauche butan (nicht vergessen, dass gauche Wesentliches einen Diederwinkel von 60 Grad impliziert). Somit ist diese diäquatoriale Konformation ist nicht mehr spannungsfrei, da die 1,4-trans diäquatoriale Konformation war, wo die Methylgruppen sind sehr weit auseinander. Das 1,2-Isomer diäquatoriale 0,9 kcal / mol weniger stabil als das 1,4-Isomer diäquatoriale ist, wegen dieser gauche Butan artige Wechselwirkung (man erinnere sich, daß das Isomer gauche in Butan um genau diesen Betrag destabilisiert wird).