Elektronenkonfiguration - Chemie, sokratische
Die Photoelektronenspektroskopie (PES).
Dieses Video ist über die Photoelektronenspektroskopie und diskutiert ausführlich die Erzeugung und Interpretation von Photoelektronenspektren von Atomen. Darüber hinaus wird in diesem Video diskutiere ich den photoelektrischen Effekt und Hacke die kinetische Energie der Elektronen mit der Energie des einfallenden Lichts entfernt zu berechnen und die Bindungsenergie, wenn Elektronen. In diesem Video diskutiere ich Details in den photoelektrischen Spektren der folgenden Elemente: - Natrium, Na - Carbon, C - Sauerstoff, O - Neon, Ne - Scandium, zudem Sc beschreibe ich, warum 4s-Orbital vor 3d-Orbitale gefüllt ist und warum Elektronen wird aus 4S vor 3d entfernt. Studenten Chemie auf verschiedenen Ebenen zu studieren könnten sehr von diesem Video profitieren.
Schlüsselfrage
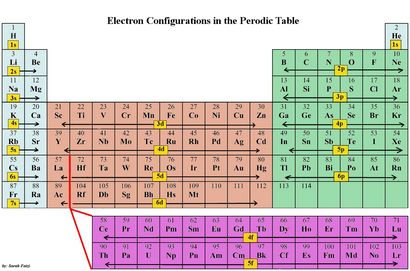
Elektronenkonfigurationen sind ein organisiertes Mittel, um die Platzierung von Elektronen zu dokumentieren, basierend auf das Energieniveau und Orbitale Gruppierungen des Periodensystemes.
H # 1 # 1s ^
Er # 1s ^ 2 #
Li # 1s ^ 2 2s ^ 1 #
Sei # 1s ^ 2 2s ^ 2 #
B # 1s ^ 2 ^ 2 2s 2p ^ 1 #
C # 1s ^ 2 ^ 2 2s 2p ^ 2 #
N # 1s ^ 2 ^ 2 2s 2p ^ 3 #
O # 1s ^ 2 ^ 2 2s 2p ^ # 4
F # 1s ^ 2 ^ 2 2s 2p ^ # 5
Ne # 1s ^ 2 ^ 2 2s 2p ^ # 6
Der Koeffizient sagt uns das Energieniveau (Zeile) des Periodensystems
Die s oder p erklären uns den Orbitalblock.
Der hochgestellte Index sagt uns, die Anzahl der Elektronen im Orbital.
Die s-Orbitale Gruppen 1 - 2 (Spalten) können zwei Elektronen aufnehmen
Die p-Orbitale Gruppen 13-18 (Spalten) können 6 Elektronen halten
Die d-Orbitale Gruppen 3-12 (Spalten) können 10 Elektronen aufnehmen.
Die f-Orbitale können 14 Elektronen aufnehmen.
Jedes Energieniveau muss, bevor ein Energieniveau bewegt sich gefüllt werden.
Jede Orbitalgruppe muss füllen bevor er zum nächsten Orbitalgruppe bewegt.
1s
2s 2p
3s 3p
3D-4S 4p
5S 4d 5P
6S 4f 5d 6P
7s 5f 6d 7p
# 1s ^ 2 ^ 2 2s 2p ^ 6 ^ 2 3s 3p ^ 6 ^ 2 4S 3D ^ 10 ^ 2 4p.
Germainum ist in der 4. Reihe Energieniveau des Periodensystems. Das Element ist in der 2. Spalte des p-Blockes, Gruppe IVA (Spalte 13).
Elektronenkonfiguration ist Chemiker Weg für die die Adresse aller Elektronen in einem Atom oder Ion der Rechnungslegung. Die Notation für die Elektronenkonfiguration auf Quantenzahlen basiert. Das Prinzip Quantenzahl ist das Energieniveau, bei dem Elektronen zu finden sind. Diese Quantenzahl von 1 bis unendlich geht aber für bekannte Elemente im Grundzustand, hat dieser Wert nicht n = 7 so weit übertroffen. Innerhalb jeden Energieniveaus gibt es Orbitale und Sub-Orbitale. Elektronenkonfigurationen Die Staaten werden einfach die orbitale und diese sind s, p, d und f.
Also, wenn Sie bei der Elektronenkonfiguration aussehen von etwa Schwefel, die als [S] = # 1s ^ (2) # # 2s ^ (2) # # 2p ^ (6) # # 3s ^ (2) # geschrieben werden würde # 3P ^ (4) #. Die Bezeichnung von 1, 2 und 3 sind die Energieniveaus. Die s- und p sind die Orbitale.
Valenzelektronen Elektronen sind es die am weitesten außen liegenden Energieniveau. Im Fall für Schwefel ist das am weitesten außen liegenden Energieniveau das höchste Energieniveau, 3. Wenn Sie also # 3s sehen ^ (2) # # 3p ^ (4) # und die Elektronen zählen, also insgesamt 6 Deshalb gibt es 6 Valenzelektronen.
Zur Vereinfachung der Materie für repräsentative Elemente, einfach auf der Gruppe sucht das Element gefunden wird, dass die Anzahl der Valenzelektronen für Sauerstoff, Schwefel und Selen in der VIA-Familie gefunden, Valenzelektronen 6. Fluor, Chlor und Brom, gefunden in 7 die VIIA Familie sind die Valenzelektronen.
Wenn bei Elektronenkonfiguration suchen. Ihre füllen, um die Elektronen:
1s
2s 2p
3s 3p 3d
4s 4p 4d 4f
5s
Gruppe 1A (1), die Alkalimetalle alle Ende s1. Was Zeit ist das Element, bestimmt in der ersten Reihe.
Beispiel: H endet in 1S1 (obwohl H ist kein Metall, liegt es in dieser Gruppe, weil es auch ein Valenzelektronen aufweist)
Li endet in 2S1 (Lithium ist in Periode 2)
Na endet in 3S1 (Natrium ist in Periode 3)
Gruppe 2-Elemente (2A), die Erdalkalimetalle, die alle Ende in s2
Gruppe 3A, oder 13 alle am Ende ihrer Elektronenkonfigurationen in P1. Boron endet in 2P1.
In der Gruppe 4A oder 14, enden alle Elemente in p2. Und so geht es.
Für die Übergangsmetalle, Gruppen 3-12, gibt es viele Ausnahmen. Die allgemeine Regel ist, dass die Elektronenkonfiguration des Elements endet in d und welchem Ort sie sich befinden. Scandium würde in 3D1 enden, Titan in 3D2, etc. Die Übergangsmetalle, um eine Periode hinter sind, weil die Elektronen in d Energie hoch sind.
Für die Elemente der Seltenen Erden (der Lanthaniden und Actiniden), enden sie in f. Viele Ausnahmen auch hier. Cerium würden in 4f2 in 4f1, Pr beenden. Diese Seltenerdmetalle sind 2 Perioden hinter weil die f-Elektronen sind sogar noch höher in der Energie als die d-Elektronen.
Der „S-Block“ das Periodensystem sind die Gruppen 1 und 2; sie enden in s1 und s2.
Der „p-Block“ das Periodensystem sind Gruppen 13-18 und endet in p1, usw.
Das „D-Block“ des Periodensystems sind Gruppen 3-12 des d-Block bilden und die Elektronenkonfigurationen Ende Elemente in d.
Der „f-Block“ auf dem Periodensystem sind die Lanthaniden und Actiniden.
Viel Glück und haben einen schönen Tag !!