Grampositive S
Machen Sie das Beste für wissenschaftliche Forschung und Informationen aus unseren 700+ begutachteten, Open Access-Zeitschriften, die mit Hilfe von 50.000+ Editorial Board Mitgliedern arbeiten und geschätzt Gutachter und 1000 wissenschaftliche Vereinigungen in der medizinischen, klinische, Pharma, Maschinenbau, Technologie und Management Fields.
Referenten und Experten treffen Inspiring unsere 3000+ Globale Conferenceseries Veranstaltungen mit mehr als 600 + Konferenzen, 1200+ und 1200+ Symposien zum Thema
Medical, Pharma, Technik, Wissenschaft, Technik und Wirtschaft
Forschung Artikel Open Access
Gail Czarnecki 2. Prabani Dissanayake 1 und Sunil Palchaudhuri 1 *
1 Institut für Immunologie und Mikrobiologie, Wayne State University, School of Medicine, Detroit, MI, USA
2 Abteilung für Kieferorthopädie und Kinderzahnmedizin, Universität Michigan, School of Dentistry, Ann Arbor, MI, USA
Die Generationszeit von diplococcic viridans Gruppe Streptokokken. S. mitis ist ungewöhnlich verlängerte wenn in reicher Brühe, die Xylit (2% oder höhere Konzentrationen) gezüchtet. Diese Xylit-exponierten Streptokokken wachsen vorwiegend in Ketten unterschiedlicher Länge mit Heterogenität der Farbe: rosa, lila und rosa und lila kombiniert. Der rosarote Teil dieser Bakterienketten erscheint als der purpurroten Teil dünner zu sein, um eine Verringerung der Zellwanddicke angibt. Zur Unterstützung der optischen Mikroskopie, Rasterelektronenmikroskopie der gleichen Bakterienpopulation zeigt eine deutliche Reduzierung der Größen, aber immer noch in Ketten. In diesen Ketten gibt es eine Variation in der Größe anzeigt, dass alle Mitglieder der diplococcic S. mitis Bevölkerung sind nicht gleichermaßen betroffen. Offenbar wird die teilweise betroffen lebensfähige Population von S. mitis, empfindlich gegen Colistin und Nalidixinsäure, wenn Xylit in gezüchtet.
Xylitol; Zellwanddicke; S. mitis; Colistin; Nalidixinsäure; Elektronenmikroskopie
Einführung
Im Jahr 1928 Dr. Fred Griffith in seiner Pathologie Bericht festgehalten, dass die beiden Arten von Kolonien, rauer und glatten Kolonien von S. pneumoniae in mikrobiologischen festen Nährmedien zu sehen sind (zum Beispiel Blut-Agar-Platte). Bisher wurden diese Kolonien nicht angemessen untersucht worden. Jedoch ist eine solche morphologischen Veränderungen (opak und transparent) von Bakterienkolonien sind auch wahr für mehrere diplococcic Gram-positive Pathogene einschließlich S. mutans (Dental) und S. mitis. Bezeichnenderweise haben diese diplococcic Gram-positive Erreger niedriges G-C-Gehalt (< 40%) but they differ in their pathogenesis. In support of our statement, it has been known that the virulence associated proteins CBP’s, CbpA, PspA and PepA are found only in S. pneumoniae except S. mitis is phylogenetically related to S. pneumonia [1 ,2 ]. Above all, this pathogen is becoming increasingly resistant to modern medicines, antibiotics and surface antigen based polyvalent vaccines and therefore, the disease “bacterial pneumonia” has created a new concern. In order to save children from pneumonia, alternative therapies which affect bacterial genetic ability used to communicate among the members of their own community are urgently needed. Signal based communication is also controlling their gene transfer ability.
Materialen und Methoden
Eine genetisch reine Kultur von S. mitis in Hirn-Herz-Infusion (BHI) wurde über Nacht in einem CO 2 jar gezüchtet. Nach etwa 24 Stunden wurde die Kultur auf 10 -4 und 10 -5 in BHI verdünnt, und für 2 bis 3 Stunden wachsen gelassen. Dann werden 0,1 ml von jeder Verdünnung wurden verteilt auf Trypticase-Soja-Agar (TSA) und TSA enthält, Colistin und Nalidixinsäure (CNA) Platten und inkubiert für 24 bis 72 Stunden unter drei verschiedenen Bedingungen: a) 37 ° C ohne CO2. b) 37 ° C mit CO2 und c) 25 ° C (Raumtemperatur). Der Titer war das gleiche unter allen drei Bedingungen. ATCC 6249 (eng verwandt mit S. pneumoniae) und S. mutans: ATCC 25175 (dental pathogen) haben wir 2 verschiedene Stämme von ATCC Sammlung erhalten wurden, verwendet. Interessanterweise zeigt S. mutans ein Wachstumsproblem bei einem pH-Wert höher als 7 (nicht veröffentlichte Daten).
Um die Wachstumskurve für S. mitis, wird alle Kulturen über Nacht in BHI-Medium herzustellen wurden 1:50 mit 0,1 ml jeder Kultur zu zwei getrennten Röhrchen Zugabe von 4,0 ml frischem BHI enthalten, und bei 37 ° C in einem Wasserbad wachsen Shaker. Die Proben wurden in fünf unterschiedlichen Zeitintervallen und jede Probe auf 10 -4 in Phosphat-gepufferter Kochsalzlösung verdünnt abgezogen. Nach dem Verdünnen, 0,1 ml jeder Kultur wurde auf die TSA-Platten ausgestrichen und bei 37 ° C inkubiert. Die bakterielle Titer wurde auf einem festen Agarmedium bestimmt durch die Kolonie bildenden Einheiten (CFU) gezählt. Die Wachstumskurve für die S. mitis in 2% Xylitol wurde durch Herstellung einer Übernachtkultur in BHI etabliert und für 24 Stunden in einer Kerze jar inkubierte. Diese Kultur wurde 100-fach verdünnt. Dann wurde 1 ml an zwei getrennten Röhrchen überführt. Das erste Rohr war eine Kontrolle, der nichts hinzugefügt wurde. In dem zweiten Röhrchen 0,1 ml eines 20% Xylit (Stammlösung) zugegeben. Beide Röhrchen wurden in einem Wasserbad bei 37 ° C unter Schütteln inkubiert. Die Proben wurden zu verschiedenen Zeitintervallen entnommen. Bei jedem Intervall wurde auf 10 -3 oder 10 -4 in phosphatgepufferter Kochsalzlösung 0,1 ml verdünnt und verteilt auf die TSA-Platten und CNA. Die Platten wurden bei 37 ° C inkubiert und die Kolonien wurden nach 24 Stunden gezählt. Das logarithmische Wachstum der Bakterien wurde durch Zählen der Kolonien überwacht die Anzahl der koloniebildenden Einheiten in verschiedenen reichen Agar (fest) Mittel herzustellen. Es gab keine Hämolyse oder Lyse von intakten Bakterien in Blut-Agar-Medien. Das MHK-Verfahren die Veränderung der antibiotischen Empfindlichkeit Muster durch die Anwesenheit von Xylit in den S. mitis Nährmedien wurden ebenfalls modifiziert [14] induziert zu untersuchen.
Rasterelektronenmikroskopie (SEM)
S. mitis wurde in BHI, das 2% Xylit über Nacht bei 37 ° C, und fixiert mit 2,5% Glutaraldehyd gezüchtet. Die Probe wurde nacheinander mit 25% absolutem Ethanol gewaschen. Nach Shadowing mit Gold für 5 Sekunden wurde die Probe bei 15 kV unter JEOL JSM-7600F sichtbar gemacht [15].
Altered Wachstumsmuster von S. mitis
Abbildung 1: Wachstumskurven von viridans-Streptokokken Gruppe (S. mitis) in 0% Xylit und 2% Xylitol.
Xylitol-induzierte Veränderung der antibiotischen Empfindlichkeit
Wir wuchsen die S. mitis in reicher Brühe mit variierenden Konzentrationen von Xylit (0% bis 6%) aus dem frühen Log-Phase bis zur Sättigung (10 4 / ml bis 10 9 / ml) (Abbildung 1). Die Xylit-exponierten Bakterien wurden dann verteilt auf drei verschiedene Wachstumsmedien: Blutagar, TSA, TSA und Antibiotika Colistin und Nalidixinsäure (CNA) enthält. Nach 24 Stunden Inkubation bei 37 ° C mit und ohne CO2. eine etwa gleiche Anzahl von Kolonien wuchsen auf allen drei Medien; aber, Kolonien auf CNA waren viel kleiner im Vergleich zu den Kolonien auf Blutagar und TSA-Medium gezüchtet, die keine Antibiotika enthalten. Wenn wir diese kleinen Kolonien (Lederberg sprühte) an eine andere frische CNA Platte, die 2% Xylitol übertragen, zeigte die übertragenen Kolonien eine ernsthafte hemmende Wirkung und wurde sichtbar nur als Mikrokolonien nach 48 Stunden Inkubation bei 37 ° C. Diese Daten führen zu der Schlussfolgerung, dass diese Mikrokolonien durch die vollständige Hemmung der Zellvermehrung (oder Zellteilung) oder beides, und die teilweise Ausnutzung des Xylit hat sie empfindlich auf die kombinierte Wirkung von Antibiotika, Colistin und Nalidixinsäure gemacht Säure (1 & mgr; g / ml jeweils). Die Colistin und Nalidixinsäure könnte ihre Ziele liegt in der Membran von S. mitis nach ihrem Wachstum für 5-7 Generationen in 2% Xylit erreichen. Allerdings ist eine solche hemmende Wirkung war viel weniger, wenn diese Antibiotika wurden getrennt zugegeben. Um diese Beobachtung zu bestätigen, eine Agardilutionstest wurde nach der erforderlichen Änderung des Protokolls von Baker et al. wie unten [14] berichtet.
Die Messung der Antibiotika-Empfindlichkeit von MIC
Im Agar-Verdünnungstest wurden die Bakterien in Muller-Hinton-Brühe verdünnt, um einen etwa Titer von 10 6 CFU und an der Oberfläche des TSA-Mediums [2] verteilt zu erreichen. In unserem Experiment dieser TSA Platten enthielten unterschiedliche Konzentrationen von Antibiotika (0% bis 100 & mgr; g / ml), Colistin und Nalidixinsäure einzeln oder zusammen. Jedoch wurden hergestellt, die Stammlösungen dieser beiden Antibiotika in sterilem destilliertem Wasser und filtriert durch eine Millipore-Filterscheiben, mit einer Porengröße von 2 um. Nach dem Autoklavieren wurde der feste Agar TSA-Medium auf 47 ° C abgekühlt, indem man sie in einem Wasserbad für 45 Minuten und dann verschiedenen Konzentrationen von Antibiotika wurden zugesetzt (Tabelle 1) zu verlassen. Wir haben auch festgehalten, dass die im Handel erhältlichen CNA Medien diese Antibiotika verlieren ihre Wirksamkeit nach Autoklavierung aber noch gramnegative E. coli K-12, S. typhimurium und zahlreiche luftgetragene Bakterien enthalten, zeigen kein Wachstum während der Lagerung bei Raumtemperatur oder bereits nach 48 Stunden Inkubation bei 37 ° C mit oder ohne CO2. Zur Unterstützung dieser Beobachtung wird der Gram-positiver S. mitis bedingt empfindlich gegen Antibiotika werden, wie durch die Bildung von Mikrokolonien in Gegenwart von Colistin (Polymyxin B oder E) und Nalidixinsäure nachgewiesen, wenn in Kombination (Tabelle 1) verwendet, .
Bakterien mit und ohne 2% Xylitol gewachsen
TSA mit Colistin und Nalidixinsäure
Tabelle 1: Antibiotic Empfindlichkeit von S. mitis in 2% Xylitol, wie durch Agar-Verdünnungstest gemessen.
Vergleich von Xylit-grown S. mitis durch optische Mikroskopie und REM
Bei allen Konzentrationen von Xylit, werden die Bakterien in ähnlicher Weise bis zur Sättigung wachsen gelassen (5 Stunden) mit und ohne Schütteln. Wenn diese Xylit-exponierten Populationen durch die Jahrhunderte alte Gram-Färbetechnik sichtbar gemacht werden, wächst die Mehrzahl der Bakterien in Ketten und eine Kombination von Farbe zeigt sowohl lila und rosa und sehr wenige lila diplococcic Individuen (2B). Offensichtlich ist die rosa Segment derselben lila Kette scheint sehr dünn und zerbrechlich. Ausfall von Kristallviolett mit den Xylit-grown Gram-positiven Bakterien stabil zu interagieren, führt zu einem Ergebnis, dass die Zellwanddicke beeinträchtigt wurde. SEM-Analyse der gleichen Population ausgesetzt 2% Xylit bestätigt in einer langen Kette, aber ihre Anwesenheit in Heterogenität der Größen (3B). 3A zeigt Bakterienkontrolle ohne Xylit. In 3B gibt es einige größere Bakterien in derselben Kette. Dies sind wahrscheinlich die Live-diejenigen, die teilweise von Xylit betroffen sind, sind aber noch in der Lage zu bilden Kolonien [12]. Diese Kolonien werden empfindlich gegen Nalidixinsäure und Colistin, wenn sie in Kombination verwendet (Tabelle 1). In der gleichen Mikroaufnahme gibt es eine Anwesenheit von normaler Größe diplococcic parent (etwa 1,8 um). Die optischen Dichtewerte bei 580 & mgr; m zeigten keinen Unterschied zwischen der Kontrolle und der 2% Xylit-exponierten Population. Was mehr ist, sind die optischen Dichtewerte zeigen keinen Unterschied keine Lyse anzeigt.
2A und B: Gram-Färbung der S. mitis Kontrolle (A) und (B) ausgesetzt zu 2% Xylitol. 2B zeigt S. mitis in Ketten mit einer Kombination von Farben. Sie stehen für zwei unterschiedliche Wachstumsphasen und damit deren Titer unterscheidet.
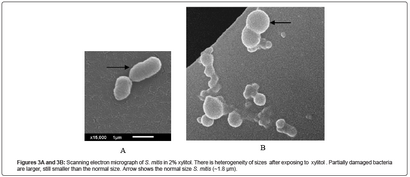

3A und 3B: Rasterelektronenmikroskopische Aufnahme von S. mitis in 2% Xylitol. Es gibt Heterogenität der Größen nach dem Xylit auszusetzen. Teilweise sind beschädigte Bakterien größer, noch kleiner als die normale Größe. Pfeil zeigt die normale Größe S. mitis (
Diskussion
Anerkennungen
Wir möchten, dass Dr. A. Palchaudhuri für die teilweise finanzielle Unterstützung und ihr Wissen in der klinischen Mikrobiologie danken.
Referenzen
Wählen Sie Ihre Sprache von Interesse, den Gesamtgehalt in Ihrem Interesse Sprache anzuzeigen