Integral Geschwindigkeitsgesetz, Halbwertszeit
Auf dieser Seite erweitern wir das Konzept der differentiellen Geschwindigkeitsgesetze auf der vorherigen Seite zu integralen Geschwindigkeitsgesetze eingeführt und Reaktionshalbwertszeit, die in den meisten praktischen Anwendungen der Kinetik von großer Bedeutung sind.
Differential- und Integralgeschwindigkeitsgesetze
Das ordentliche Geschwindigkeitsgesetz (genauer als das momentane oder Differenzgeschwindigkeitsgesetz bekannt) sagt uns, wie die Geschwindigkeit einer Reaktion auf den Konzentrationen der Reaktanden abhängt. Aber für viele praktische Zwecke ist es wichtig zu wissen, wie sich die Konzentrationen der Reaktanden (und Produkte) mit der Zeit ändern.
wenn Sie eine Reaktion in industriellem Maßstab zum Beispiel die Durchführung sind, würden Sie wissen wollen, wie lange es dauern wird für, sagen wir, 95% der Reaktanden in Produkte umgewandelt werden.
Dies ist der Zweck eines integrierten Geschwindigkeitsgesetz.
Die Integration des Geschwindigkeitsgesetz
Dies ist einfach zu tun, aber nur einige Kurse erwarten, dass Sie wissen, wie es zu tun. Für einen schnellen Durchlauf, klicken Sie hier. Wenn Sie noch ein wenig Kalkül gehabt haben, hier ist eine Gelegenheit, um es zu benutzen!
Ausdruck die „Geschwindigkeit“ eine Reaktion: die Halbwertszeit
Wie lange dauert es, eine chemische Reaktion unter einem gegebenen Satz von Bedingungen auftreten? Wie bei vielen „einfachen“ Fragen kann keine sinnvolle Antwort, ohne genau zu sein mehr gegeben. In diesem Fall,
Wie definieren wir den Punkt, an dem die Reaktion „beendet“?
Wenn die Gleichgewichtskonstante recht groß ist, dann verringert sich die Antwort auf eine einfachere Form: die Reaktion abgeschlossen ist, wenn die Konzentration eines Reaktanden auf Null fällt. Im Interesse der Einfachheit halber gehen wir davon aus, dass dies der Fall in dem Rest dieser Diskussion ist.
Der spezielle Fraktion einer wählt, hängt von den Kosten der Reaktanten in Bezug auf den Wert der Produkte, symmetrisch gegen die Kosten des Prozesses für eine längere Zeit oder die Unannehmlichkeit für weiteres Betrieb Produkt des Wartens. Diese Art der Betrachtung ist besonders beachtlich in industriellen Prozessen, in denen die Salden dieser Kosten die Wirtschaftlichkeit des Betriebs beeinflussen.
Die Halbwertszeit einer Reaktion
Anstatt zu versuchen, die erforderliche Zeit für die Reaktion zu identifizieren, abgeschlossen werden, es ist viel praktischer, die die Zeit für die Konzentration eines Reaktanden auf der Hälfte ihres ursprünglichen Wertes fallen erforderlich zu spezifizieren. Dies wird als die Halbwertszeit bekannt (oder die Halbzeit) der Reaktion.
Reaktionen erster Ordnung
Das Gesetz der exponentiellen Änderung
Die Rate, bei dem ein Reaktant in einem ersten Ordnung Prozess verbraucht wird, ist zu diesem Zeitpunkt zu seiner Konzentration proportional. Diese allgemeine Beziehung, in denen bereits eine Menge mit einer Rate ändert, die auf ihrem Momentanwert abhängt. gesagt wird ein exponentielles Gesetz zu folgen.
Das erste Ordnung integrierte Geschwindigkeitsgesetz
A → Produkte
ist ein typisches Beispiel für das Gesetz der exponentiellen Veränderung. Für ein Reaktant A, wird seine Konzentration [A] T zum Zeitpunkt t gegeben durch
in welcher [A] o ist die Anfangskonzentration und K ist die erste Ordnung Geschwindigkeitskonstante.
Dies hat die Form einer Gleichung für eine gerade Linie
Nach einem Zeitraum von einer Halbwertszeit, t = tn-Wert und wir können schreiben
(In dem wir die exponentiellen als eine Funktion, um auszudrücken, um es prominent mehr abheben.) Logarithmieren beiden Seiten (denken Sie daran, dass
ln e x = x) ergibt
Die Lösung für die Halbwertszeit, erhalten wir die einfache Beziehung
die uns sagt, dass die Halbwertszeit einer Reaktion erster Ordnung eine Konstante ist. Dies bedeutet, dass 100.000 Moleküle eines Reaktanden zu 50.000 im gleichen Zeitintervall für zehn molcules auf fünf reduziert werden muß reduziert werden.
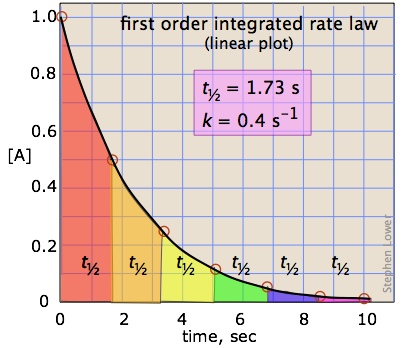
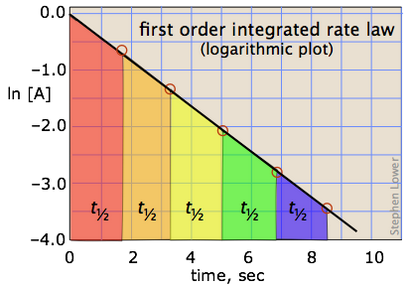
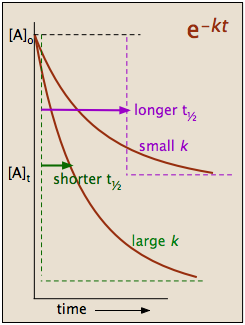
Es sollte klar sein, dass die Rate konstant, und die Halbwertszeit eines Prozeß erster Ordnung sind umgekehrt proportional.
Die Halbwertszeit einer Reaktion erster Ordnung gefunden wurde 10 min bei einer bestimmten Temperatur zu sein. Was ist die Geschwindigkeitskonstante in reziproken Sekunden?
Der Masse-241-Isotop von Americium, das weithin als Ionisationsquelle in Rauchmeldern verwendet wird, hat eine Halbwertszeit von 432 Jahren.
c) Was wäre das „siebte Leben“ Am 241?
Reaktionen zweiter Ordnung
Integration des Geschwindigkeitsgesetz zweiter Ordnung
Die Halbwertszeit ist gegeben durch
(Siehe hier)
Beachten Sie, dass die Halbwertszeit einer Reaktion zweiter Ordnung von der Anfangskonzentration abhängt, im Gegensatz zu seiner Konstanz für eine Reaktion erster Ordnung. Aus diesem Grunde ist das Konzept der Halbwertszeit für eine Reaktion zweiter Ordnung weit weniger nützlich.
Zero-Bestellprozesse
In einigen Reaktionen ist die Rate scheinbar unabhängig von dem Reaktions concentraton, wobei in diesem Fall
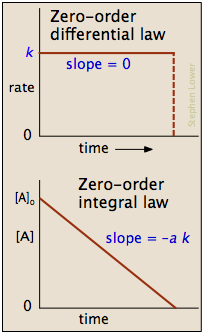
Beachten Sie das Wort „scheinbar“ im vorhergehenden Satz; Kinetik nullter Ordnung ist immer ein Artefakt der Bedingungen, unter denen die Reaktion durchgeführt. Aus diesem Grunde Reaktionen, die Kinetik nullter Ordnung folgt, werden oft als pseudo-nullter Ordnung Reaktionen.
Offensichtlich nullter Ordnung Prozess kann nicht fortgesetzt werden, nachdem ein Reaktant erschöpft ist. Kurz bevor dieser Punkt erreicht ist, wird die Reaktion auf einen anderen Geschwindigkeitsgesetz zurückkehren, anstatt direkt auf Null fallen, wie sie in der oberen linken dargestellt.
Es gibt zwei allgemeine Bedingungen, die zu Null Ordnung Raten geben kann:
- Nur ein kleiner Teil der Reaktantmoleküle ist in einer Lage oder Zustand, in dem sie in der Lage sind zu reagieren, und dieser Anteil kontinuierlich aus dem größeren Pool nachgefüllt wird.
Diese Situation tritt häufig auf, wenn eine Reaktion, die durch die Befestigung an einer festen Oberfläche (heterogene Katalyse) oder an ein Enzym katalysiert wird.
in Gegenwart eines heißen Platindraht (der als Katalysator wirkt) ist nullter Ordnung, aber es folgt konventionelleren Kinetik wenn vollständig in der Gasphase durchgeführt.
Dies wird am häufigsten gesehen, wenn zwei oder mehr Reaktanden beteiligt sind. Wenn also die Reaktion
ist erste Ordnung in beiden Reaktanten, so dass
Rate = k [A] [B]
dann, wenn B vorhanden in großem Überschuß vorhanden ist, erscheint die Reaktion nullter Ordnung in B (und erster Ordnung insgesamt) zu sein. Dies geschieht häufig, wenn B H 2 O und die Reaktion wird in wäßriger Lösung durchgeführt.
Die folgende Tabelle vergleicht die Geschwindigkeitsparameter von null-, erster und zweiter Ordnung Reaktionen der Form A A → Produkte. Siehe auch diese ausgezeichnete Seite von der Purdue University, die Plots von [A] zeigt, ln [A] und 1 / [A] für die einzelnen Reaktionsordnung.