PH-Wert von Wasser - Umweltmesssysteme
Was ist pH-Wert?
pH-Wert ein bestimmte Wert, basierend auf einer definierten Skala, ähnlich wie die Temperatur. Dies bedeutet, dass der pH des Wassers ist nicht ein physikalischer Parameter, der als Konzentration oder in einer Menge, gemessen werden kann. Stattdessen ist es eine Zahl zwischen 0 und 14 definiert, wie sauren oder basischen einem Gewässer entlang einer logarithmischen Skala ¹ ist. Je niedriger die Zahl, desto saurer das Wasser ist. Je höher die Zahl, desto Grund es ist. Ein pH-Wert von 7 wird als neutral. Die logarithmische Skala bedeutet, dass jede Zahl unter 7 ist 10mal saurer als die vorherige Zahl beim Zählen nach unten. Ebenso, wenn sie über 7 Zählen, jede Zahl ist 10mal basischer als die vorherige Nummer ².
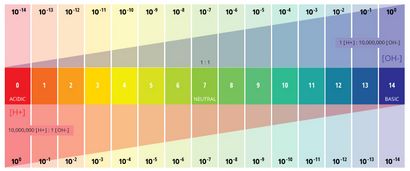
pH steht für die „power of hydrogen“ ³. Der numerische Wert von pH-Wert wird durch die molare Konzentration von Wasserstoffionen (H +) ³ bestimmt. Dies geschieht, indem den negativen Logarithmus des H + -Konzentration (-log (H +)) durchgeführt. Wenn beispielsweise eine Lösung mit einem H + -Konzentration von 10 -3 M aufweist, wird der pH-Wert der Lösung -log (10 -3), der gleich 3 ist.
Säuren und Basen
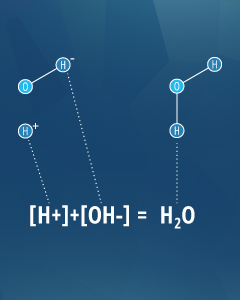
Säure-Base-Paare können sich wie H + und OH- neutralisieren in dieser Gleichung tun.
Basic oder Alkaline
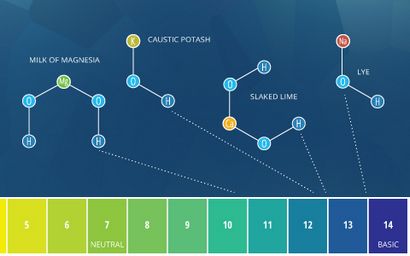
Gängige Beispiele für Alkali schließen Milch von Magnesia - Mg (OH) 2, Kalilauge - KOH, gelöschtem Kalk / Kalkwasser - Ca (OH) 2, und Natronlauge (Lauge) - NaOH.
Die Begriffe „alkalisch“ und „basic“ bedeutet ungefähr das Gleiche. Durch die Bronsted-Lowry-Definition beschreibt grundlegende jede Substanz, die die Wasserstoffionenkonzentration und erhöht den pH-Wert von Wasser, oder in anderen Worten reduziert, eine Basis ⁴. Alkaline kommt von Alkali, die Metallelemente an ionischen Verbindungen (Salze), enthaltend Alkali- oder Erdalkali bezieht, die Hydroxid-Ionen bilden, wenn sie in Wasser gelöst ⁵. Alkalisalze sind sehr häufig und leicht auflösen. Aufgrund der Hydroxidionen sie produzieren (die pH-Erhöhung), alle Alkalien sind Basen. Einige Quellen definieren beliebige lösliche Base wie ein Alkali ⁵. Als solche lösliche Basen können als „Basis“ oder „alkalischen“ beschrieben werden. Jedoch unlösliche Basen (wie Kupferoxid) sollten nur als Grund beschrieben werden, nicht alkalisch.
Alkalität und der pH-Wert des Wassers
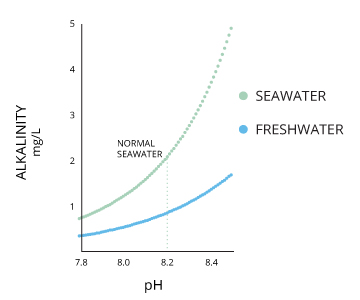
Alkalinität und pH-Wert werden bei 100% Luftsättigung in direktem Zusammenhang.
Einheiten pH-Wert und Alkalität
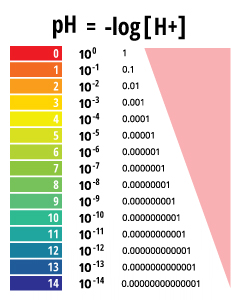
pH-Werte werden auf einer logarithmischen Skala bestimmt.
Da jedoch die pH-Skala logarithmisch ist, würde auf durchschnittlich zwei pH-Werten versucht sein mathematisch nicht korrekt. Wenn ein Mittelwert benötigt wird, kann es als Median oder einen Bereich gemeldet wird, nicht als eine einfache Berechnung ¹⁰.
Alkalinität kann als mg / L oder Mikroäquivalente pro Liter (mmol / l) angegeben werden. Wenn in mg / L, bezieht er sich auf Carbonat (CO 3 2-), Bicarbonat (HCO 3 -) oder Calciumcarbonat (CaCO3) -Konzentrationen, obwohl Calciumcarbonat gebräuchlichste ¹¹ ist.
Warum ist pH wichtig?
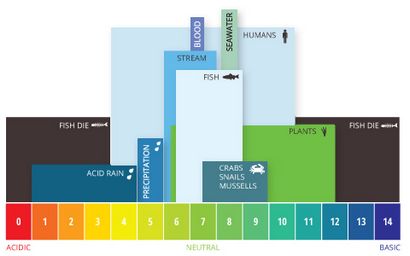
Aquatic pH-Werte. Die optimalen pH-Werte für Fische sind 6,5 bis 9,0. Außerhalb der optimalen Bereiche, Organismen betont werden oder sterben.
Wenn der pH-Wert des Wassers zu hoch oder zu niedrig ist, die Wasserorganismen in ihr leben, werden sterben. pH-Wert kann auch die Löslichkeit und Toxizität von Chemikalien beeinflussen und Schwermetalle in dem Wasser ¹². Die Mehrheit der Wassertiere bevorzugt einen pH-Bereich von 6,5 bis 9,0, obwohl einige in Wasser mit pH-Werten außerhalb dieses Bereichs leben kann.
Als pH-Werte bewegen sich von diesem Bereich entfernt (nach oben oder unten) ist es Tiersysteme strapazieren kann und reduziert das Schlüpfen und Überlebensraten. Je weiter außerhalb des optimalen pH-Bereich ein Wert ist, desto höher sind die Raten Mortalität. Je empfindliche Spezies, die stärker betroffen ist durch Veränderungen des pH-Wertes. Zusätzlich zu dem biologischen Wirkungen, in der Regel extreme pH-Werte, die Löslichkeit von Elementen und Verbindungen erhöhen, so dass giftige Chemikalien mehr „mobilen“ und das Risiko der Absorption durch das Leben im Wasser zu erhöhen ¹³.
Wasser lebenden Arten sind nicht die Einzigen, die durch pH-Wert beeinflusst. Während Menschen eine höhere Toleranz für pH-Werte (trinkbar Stufen 4-11 mit minimaler Magen-Darm-Reizung-Bereich) haben, gibt es immer noch betrifft ¹⁴. pH-Werten von mehr als 11 kann Haut- und Augenreizungen verursachen, ebenso wie einen pH-Wert unter 4. Ein pH-Wert unter 2,5 wird eine irreversible Schädigung der Haut und Organ Futter verursachen ¹⁴. Niedrigere pH-Wert erhöht das Risiko von mobilisierten giftige Metalle, die auch von den Menschen aufgenommen werden können, und Werte über 8,0 nicht wirksam mit Chlor desinfiziert werden, so dass andere indirekte Risiken ¹⁴. Darüber hinaus außerhalb der Ebene pH 6,5-9,5 können Rohre und andere Systeme beschädigen und korrodieren, weitere Schwermetalltoxizität erhöht.
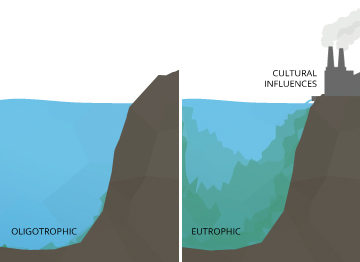
Eine geringfügige Erhöhung des pH-Wert kann eine oligotrophen (reich an gelöstem Sauerstoff) See verursacht eutrophe werden (für gelösten Sauerstoff fehlt).
Selbst kleinere pH-Veränderungen können langfristige Auswirkungen haben. Eine leichte Veränderung des pH-Wert des Wassers kann die Löslichkeit von Phosphor und anderen Nährstoffen erhöhen - sie zugänglicher für das Pflanzenwachstum machen ¹⁰. In einem oligotrophen See oder einen Sees niedrig in Pflanzennährstoffen und in hohem Gehalt an gelöstem Sauerstoff kann dies zu einer Kettenreaktion führen. Mit mehr zugänglich Nährstoffen, Wasserpflanzen und Algen gedeihen, für gelösten Sauerstoff, um die Nachfrage zu erhöhen. Dies schafft eine eutrophe See, die reich an Nährstoffen und Pflanzenwelt, aber niedrig in Konzentrationen von gelöstem Sauerstoff. In einem eutrophen See, andere Organismen im Wasser leben, gestresst, auch wenn pH-Werte im optimalen Bereich bleibt.
Faktoren, die den pH-Wert des Wassers beeinflussen
Es gibt viele Faktoren, die pH-Wert im Wasser beeinflussen kann, sowohl natürliche als auch vom Menschen gemacht. Die meisten natürlichen Veränderungen treten aufgrund von Wechselwirkungen mit Felsen umgebenden (insbesondere kohlen Formen) und andere Materialien. pH-Wert kann auch mit Niederschlag (insbesondere sauren regen) und Abwasser oder Bergbau Entladungen ¹³ schwanken. Darüber hinaus kann die CO2-Konzentration pH-Werte beeinflussen.
Kohlendioxid und pH
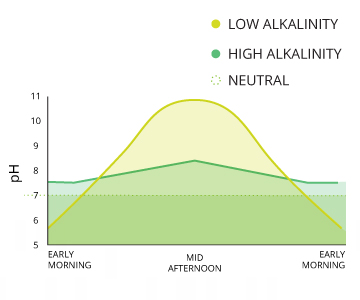
pH-Werte können aufgrund der Photosynthese und Atmung im Wasser schwanken täglich. Der Grad der Veränderung hängt von der Alkalität des Wassers.
Während Kohlendioxid in Wasser in einem gelösten Zustand vorhanden ist (wie Sauerstoff), kann es auch mit Wasser reagiert Kohlensäure zu bilden:
CO2 + H2O <=> H2CO3
H2CO3 kann dann eine oder beide seiner Wasserstoffionen verlieren:
H2CO3 <=> HCO 3 - + H + .... HCO 3 - <=> CO3 2- + H +

Die obigen Gleichungen auch erklären, warum regt einen pH-Wert von etwa 5,65 ¹⁵ hat. Als Regentropfen durch die Luft fallen, interagieren sie mit Kohlendioxid-Moleküle in der Atmosphäre. Dies schafft H2CO3 in den Regentropfen, die regen den pH-Wert senken ¹⁷. Ein pH-Wert von 5,65, obwohl sauren, nicht sauren regen betrachtet. Natürlich, unverschmutzte regt oder Schnee wird erwartet, pH-Werte in der Nähe von 5,6 hat, eine Standard-atmosphärische CO2-Konzentration von 0,0355% ¹⁵ vorausgesetzt. Säure regen erfordert einen pH-Wert unter 5,0 ²¹.
Natürlichen pH-Einflüsse
Karbonatmaterialien und Kalkstein sind zwei Elemente, die pH-Änderungen in Wasserpuffer kann. Calciumcarbonat (CaCO3) und andere Bicarbonate können sowohl mit Wasserstoff oder Hydroxylionen kombinieren pH¹⁸ zu neutralisieren. Wenn Karbonatmineralen im Boden vorhanden sind, wird die Pufferkapazität (Alkalinität) des Wassers erhöht wird, um den neutralen pH-Wert von Wasser in der Nähe zu halten, selbst wenn Säuren oder Basen zugesetzt werden. Zusätzliche Karbonatmaterialien hinaus kann neutrales Wasser leicht basisch machen.

Kalksteinbrüche haben höhere pH-Werte aufgrund der Karbonatmaterialien in dem Stein.

Blitze können den pH-Wert senken, regen.

Man-Made pH Beeinflusser
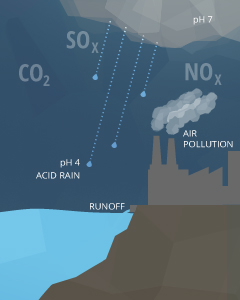
Verschmutzung in der Luft, den Boden oder direkt im Wasser können alle beeinflussen pH-Wert.
Typische pH-Werte

Empfohlene Mindest pH-Wert für das Leben im Wasser.
Typische pH-Werte variieren aufgrund von Umwelteinflüssen, insbesondere Alkalität. Die Alkalinität des Wassers variiert aufgrund der Anwesenheit von gelösten Salzen und -carbonate, sowie die mineralische Zusammensetzung der umgebenden Erde. Im Allgemeinen, desto höher ist die Alkalität, desto höher der pH-Wert; desto geringer ist die Alkalität, desto niedriger ist der pH-Wert ⁶. Der empfohlene pH-Bereich für die meisten Fische zwischen 6,0 und 9,0 mit einem Minimum Alkalität von 20 mg / l, mit idealen CaCO3 Niveaus zwischen 75 und 200 mg / l ²⁰.
Meeresorganismen wie Anemonenfisch und Korallen erfordern höhere pH-Werte. pH-Werte unter 7,6 wird Korallenriffe verursachen beginnen tun Calciumcarbonat auf den Mangel zu kollabieren ³⁹. Sensitive Süßwasserarten wie Lachs bevorzugen pH-Werte zwischen 7,0 und 8,0, stark beunruhigt zu werden und auf einem Niveau unter 6,0 ⁴⁰ physiologischen Schäden aufgrund von absorbierten Metalle leiden.
Meerwasser hat einen pH-Wert um 8,2, obwohl dies zwischen 7,5 bis 8,5 in Abhängigkeit von seiner lokalen Salinität reichen kann. pH-Werte werden mit Salzgehalt erhöhen, bis das Wasser erreicht Calcium-Karbonat (CaCO 3) Sättigungs ¹⁶. Die Ozeane haben im allgemeinen eine höhere Alkalität durch Carbonatgehalt und somit eine größere Fähigkeit, freie Wasserstoffionen zu puffern ²⁷.
Süßwasser Seen, Teiche und Flüsse haben in der Regel ein pH-Wert von 6-8 in Abhängigkeit von dem umgebenden Boden und Grundgestein ²¹. In tieferen Seen, wo Schichtung (layering) auftritt, ist der pH-Wert des Wassers im allgemeinen höher (7.5-8.5) in der Nähe der Oberfläche und untere (6,5-7,5) in größeren Tiefen ¹⁰. Einige Staaten, wie zum Beispiel Alaska, versuchen, einen pH-Standard für die Wasserqualität zu erhalten. Der Alaska Wasserqualitätsstandard erfordert pH-Werte zwischen 6,5 und 8,5 die vielen Lachspopulationen in dem Staat zu schützen ⁴⁰.
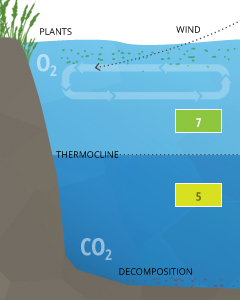
Schichtungs können pH-Werte innerhalb eines Gewässers verursachen oberhalb und unterhalb des cline abweichen.
Stratifizierung Überlegungen
Schichtungs wird üblicherweise durch Temperaturunterschiede innerhalb eines Körpers aus Wasser verursacht, wobei jede Schicht von Wasser nicht mit den Schichten über oder unter ³⁷ mischt. Diese Schichten werden durch clines getrennt, bekannt als Thermokline (Temperatur dividieren) oder chemoclines (Chemie-Gradienten). Chemoclines kann auf Sauerstoff basieren, Salinität oder andere chemische Faktoren, die, wie Kohlendioxid nicht die cline überqueren. Durch Wasser CO2 Einfluss auf den pH-Wert von kann Schichtung verursachen pH-Werte über einen Cline zu unterscheiden.
Anpassungsfähigkeit
Während ideale pH-Werte für Fische sind 7-8 (Fischblut einen pH-Wert von 7,4 hat) ²⁰, können die meisten Fische so lange auf den pH-Wert ihrer Umgebung (6,0-9,0) anzupassen, da es keine dramatischen Schwankungen sind. Eine drastische Schwankung wird eine Verschiebung des pH-Werts von 1,4 (nach oben oder nach unten) ²² betrachtet. Für Seefische, sollte der pH-Wert des Wassers bleibt zwischen 7,5 und 8,5 ⁹.
Ungewöhnliche pH-Werte und Konsequenzen

Steinkorallen beginnen als Karbonat und pH-Werte fallen zu bleichen und verschlechtern.
Schädliche Auswirkungen bemerkbar machen, wenn der pH-Wert des Wassers unter 5,0 fällt oder über 9,6 steigen. Üble Folgen aufgrund Versauerung sind stärker ausgeprägt in Seefische aufgrund ihrer Anpassung an einen höheren pH-Wert. Bei pH-Wert unter einem optimalen Niveau ist, werden Fische anfällig für Pilzinfektionen und andere körperliche Schäden ¹⁶. Da der pH-Wert des Wassers fällt, wird die Löslichkeit von Calciumcarbonat vermindert, Schalenwachstum in Wasserorganismen Hemmen ¹⁶. Im Allgemeinen Fischreproduktion wird bei pH-Werten unter 5,0 und vielen Arten (wie Seefische oder sensible Süßwasserfische wie Schwarzbarsch) verlassen den Bereich ²¹ betroffen. Fische beginnen zu sterben, wenn pH-Wert unter 4,0 ¹² fällt.

Schwermetalle sind giftiger bei niedrigeren pH-Werten.
Niedrige pH-Werten können die Löslichkeit von Schwermetallen ¹² fördern. Da die Höhe der Wasserstoffionen zunehmen, Metallkationen, wie Aluminium, Blei, Kupfer und Cadmium in das Wasser freigesetzt, anstatt dass sie in das Sediment aufgenommen. Da die Konzentrationen von Schwermetallen zu erhöhen, ihre Toxizität erhöht auch. Aluminium kann Wachstum und die Vermehrung begrenzen, während Sterblichkeitsraten Erhöhung so günstig wie 0,1-0,3 mg / L ²² bei Konzentrationen. Darüber hinaus können mobilisierte Metalle durch Organismen während der Atmung aufgenommen in werden, was zu physiologischen Schäden ²². Dies ist besonders schädlich für Arten wie Regenbogenforelle ¹³.
Auf der anderen Seite des Spektrums, kann eine hohe pH-Werte Kiemen und die Haut von Wasserorganismen schädigen und verursachen Tod bei Niveaus über 10,0. Während einige afrikanische Cichliden bei hohen pH-Werten (bis zu 9,5) gedeihen, können die meisten Fische vertragen sie nicht. Der Tod kann auch bei typischen Ebenen auftritt (9.0), wenn Ammoniak im Wasser vorhanden ist ²¹. Bei niedrigen und neutralen pH-Werten, kombiniert Ammoniak mit Wasser ein Ammoniumion zu erzeugen:
NH3 + H2O <=> NH4 + + OH -

Niedrige pH-tolerante Algen bilden Blüten, die den See töten.
Ammonium, NH4⁺, ist ungiftig und nicht das Leben im Wasser beeinflussen. Jedoch bei pH-Werten über 9, die Gleichung umkehrt und Ammoniak wird in das Wasser freigesetzt ²². Ammoniak, NH3, ist extrem giftig für Wasserorganismen und als pH-Wert steigt, steigt die Mortalitätsraten bei der NH3-Konzentration.
Auf das Ökosystem Seite kann Moosen einen Körper aus Wasser eindringenden beginnen, wie der pH-Wert des Wassers unter 5. In eutrophe Seen fällt, pH toleranten Algen dominieren kann, den pH-Wert auf Tages hohen und niedrigen Extremen fahren, Algenblüten bilden, die töten der See ¹⁶.
Alkalische und saure Seen
Verteilt auf der Welt gibt eine Reihe von Seen mit ungewöhnlichen pH-Werten. Alkalische Seen, die auch als Natronseen bekannt ist, haben in der Regel einen pH-Wert zwischen 9 und 12. Dies wird oft durch einen hohen Salzgehalt (wenn auch nicht jeder Salzsee einen hohen pH-Wert hat). Diese Seen haben hohe Konzentrationen von Mineralstoffen, insbesondere gelöste Salze: Natrium, Calcium, Magnesium und -bicarbonate ²⁸. Je nach den See, Borate, Sulfate und andere Elemente (in der Regel starke Basis-Ionen) können ebenfalls vorhanden ²⁹ sein. Alkalische Seen werden gebildet, wenn der einzige Auslass für die Wasserverdampfung ist, die Mineralien Zurücklassung zu akkumulieren ³⁰. Diese Mineralien bilden oft Spalten von Mineralvorkommen, wie Tuffstein Säulen bekannt. Viele alkalischen Seen sind eine kommerzielle Ressource für Soda und Pottasche, während andere sind beliebte Touristenziele für ihre „magischen“ heilenden Eigenschaften (aufgrund der Mineralgehalt).
Soap Lake in Washington ist ein alkalisches See haben heilende Eigenschaften (Photo Credit: Steven Pavlov über Wikipedia Commons) angenommen
Schwefel und Eisenablagerungen in einem der Dallol-Säure Seen.
Die sauren Seen am Dallol in Äthiopien sind das Ergebnis der Säurelaugung von umliegenden Vulkanen. Der Schwefel und Eisen im Wasser verlassen gelb und rostfarbenen Ablagerungen um den Rand des Wassers.
Bei einem pH-Wert unter 5,0, können nur wenige Organismen in sauren Seen leben. Allerdings gibt es eine bemerkenswerte Ausnahme: die Osorezan Hasel oder Japanisch Hasel. Dieser Fisch lebt in dem sauren Wasser des Sees Osorezan, bequem bei einem pH-Wert von 3,5 ruhte, und schwimmt in nur neutrale pH-Wert Gewässer zum Laichen ³⁴.
Ozeanversauerung
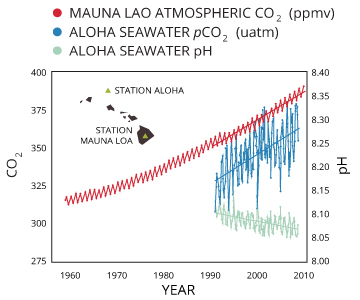
Wie im Abschnitt „Kohlendioxid und pH“ erwähnt wird, zusätzliche CO2 erhöhen die Anzahl der Wasserstoffionen im Wasser zu reduzieren pH:
CO2 + H2O <=> H2CO3 ... H2CO3 <=> (H +) + HCO3⁻
Bei pH-Werten zwischen 6,4 und 10,33, schließen einige dieser Wasserstoffionen zu Carbonationen ²²:
(H +) + CO3 2- <=> HCO 3 -
CO2 + H2O + CO3²⁻ <=> 2HCO3⁻
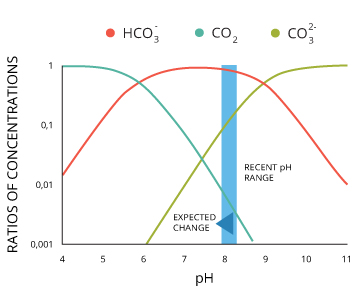
Hohe CO2-Wert macht es auch schwierigen Strom Schalen zu halten durch pH-Werte und den Wettbewerb um Karbonat ³⁵ zu senken.
Darüber hinaus wird die Luftsättigung des Wassers basierend auf Partialdrücke von Henrys Gesetz. Als CO2-Gehalt in der Luft zu erhöhen, steigt auch ihr Partialdruck. Dies reduziert den Partialdruck des Sauerstoffs, dessen Sättigungsniveaus zu reduzieren und einen Beitrag zu hypoxischen (niedrige O2) Bedingungen ³⁵.