Diffusion und Erguss Graham s Law - Video & Lektion Transcript
Haben Sie schon einmal in einem Zimmer, in denen jemand auf Parfüm oder Duft Lotion und ein paar Minuten später, es zu riechen Sie sind in der Lage gebracht hat? Was sind die Ursachen Sie in der Lage sein, etwas zu riechen von so weit weg? In dieser Lektion werden wir die kinetische molekularen Theorie der Gase verwenden, einige ihrer Verhaltensweisen zu erklären und bestimmen, wie wir die Geschwindigkeiten verschiedener Gase vergleichen können.
Kinetic Molecular Theory
Die Erklärung dieser aromatischen Frage liegt in der kinetischen Molekulartheorie. die beschreibt, um die Bewegung der idealen Gasteilchen. Es besagt, dass Gasteilchen ständig in zufälliger, schnellen Bewegung bewegen. Also, wenn Sie genug Partikel (oder in diesem Fall Cookie Geruch Moleküle) in einer zentralen Stelle, werden sie schließlich ausgebreitet, weil sie zufällig und schnell bewegen.
Die Chemie Wort für dieses Phänomen ist die Diffusion. die die Bewegung einer Substanz durch eine andere. Normalerweise bedeuten Teilchen ausbreiten, oder bewegen sich von einem Bereich hoher Konzentration zu einem Bereich mit niedriger Konzentration. In meinem Schokoladenkeks Beispiel der Gaspartikel, die die Gerüche des Cookies enthalten, bewegen sich durch die Luft von einer hohen Konzentration (die Bäckerei) auf eine niedrige Konzentration (den Bürgersteig und Umgebung).
Nachdem Johnny das Cookie kaufte er fertig ist, fährt er fort, auf seinem Weg. Eine Weile später bemerkt er etwas Eigenartiges über seinen Ballon: es scheint, versinkt zu werden. Was war einmal ein hochfliegender ist Heliumballon jetzt nur ein Schweben und etwas kleiner Ballon. Was denken Sie Johnnys Ballon verursacht einige seiner Helium zu verlieren?
Nun, ein Phänomen, das als Erguss schuld ist. Effusion ist, wenn Gasaustritt durch winzige Löcher in einem Behälter Partikel. Effusion tritt aus dem gleichen Grunde wie Diffusion: Gasteilchen in einer zufälligen, schnellen Bewegung bewegen. Da Heliumatome so klein sind und Licht (Helium ist das leichteste nicht brennbare Gas), können die Teilchen leicht durch die mikroskopisch kleine Löcher in dem Ballon entweichen, um den Ballon zu verursachen, um immer kleiner und dichten, wodurch es versenken.
Graham Gesetz
Graham festgestellt, dass leichtere Gasmoleküle schneller als schwereres Gasmolekül.
In der Mitte der 1800er, experimentiert Thomas Graham mit Erguss und entdeckt eine sehr wichtige Beziehung: leichtere Gasmoleküle schneller reisen als schwerere Gasmoleküle.
Also, vorausgesetzt, die Temperatur und der Druck konstant bleiben, Atome oder Moleküle mit niedrigerem Molekulargewicht wird mit einer höheren Molekularmasse schneller als Atome oder Moleküle effuse. Graham ging sogar noch weiter, indem herauszufinden, wie viel schneller ein Molekül über eine andere wäre.
Dies wurde als Grahams Gesetz bekannt. und es heißt, dass das Erguss Rate eines Gases ist umgekehrt proportional zur Quadratwurzel der Molekülmasse. Üblicherweise wird diese Formel benutzt, wenn die Sätze von zwei verschiedenen Gasen in gleichen Temperaturen und Drücken zu vergleichen. Das Verhältnis der Rate (oder Geschwindigkeit) von Gas A über Gas B ist zur Quadratwurzel der Masse des Gases B über die Masse des Gases gleich A.
Praxis Problem 1
Also, lassen Sie sie versucht, diese Gleichung mit dem folgende Szenario: Wenn Sauerstoffmoleküle mit einer durchschnittlichen Rate von 3 mol / s effuse, wie schnell würden Wasserstoffmoleküle effuse in den exakt gleichen Bedingungen?
Lassen Sie uns beginnen, indem sie in den Informationen füllen wir wissen, und wir nennen Wasserstoff ‚Gas A‘ und Sauerstoff ‚Gas B‘. Wir wissen, die Rate des Gas B ist 3 mol / s und die Molekülmasse von Sauerstoff (ein zweiatomiges Element) 32 amu. Die Molekülmasse von Wasserstoff (auch zweiatomigen) 2 amu.
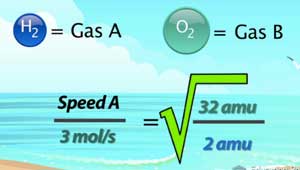
Mein erster Schritt des in der Lösung ist die rechte Seite der Gleichung zu berechnen. 32 durch 2 geteilt ist 16. Hinweis, wie die Einheiten aufheben. Die Quadratwurzel von 16 ist 4. für x zu lösen, würden wir beiden Seiten multiplizieren müssen einfach von 3 mol / s, das gibt uns eine Antwort von 12 mol / s. Also, wenn Sauerstoff mit einer Rate von 3 mol / s effusing würde Wasserstoff 4-mal schneller effusing sein mit einer Rate von 12 mol / s.
Schalte Inhalt
Mehr als 55.000 Stunden in allen wichtigen Themen
KOSTENLOSER Zugriff für 5 Tage,
nur ein Konto erstellen.
Keine Verpflichtung, jederzeit kündbar.
Wählen Sie ein Thema, um eine Vorschau im Zusammenhang Kurse:
Es ist wichtig zu erwähnen, dass die Geräte auf beiden Seiten sind nicht wichtig, solange sie das gleiche sind. Auf der linken Seite der Gleichung, könnten Sie alle Raten Einheiten (Mol pro Sekunde, Moleküle pro Sekunde, Meter pro Sekunde, Meilen pro Stunde) verwenden und auf der rechten Seite der Gleichung keine Masseneinheiten verwendet werden könnten (amu für die molekularen Masse oder g / mol Molmasse). Sie müssen nur die Einheiten auf der Oberseite stellen Sie sicher, und der Boden der Fraktionen sind gleich. Diese Formel funktioniert gut für die Rate des Erguss in vielen Situationen zu finden, und es ist eine gute Näherung für die Permeationsraten von zwei Gasen zu vergleichen.
Praxis Problem 2
Für dieses letzte Problem, werden wir die Preise von Ethanol (ein üblicher Bestandteil in Parfüm), C2H6O und Ammoniak, NH3 zu vergleichen. Wenn eine Flasche wurden jeweils in einem Abstand von Ihnen geöffnet, was würden Sie zuerst riechen?
Wir würden diese Frage nicht brauchen die Gleichung zu gründen zu beantworten - wir würden nur bestimmen müssen, was man am leichtesten, aber wir werden die Gleichung aufzustellen nur ein wenig mehr Praxis zu bekommen. So lassen Sie sich durch die Zuordnung des Ammoniaks als ‚Gas A‘ und Ethanol als ‚Gas B.‘ beginnen Setzt man die molekularen Massen von jeweils in die rechte Seite der Gleichung gibt uns die Quadratwurzel von 46 geteilt durch 17. Wenn wir diese berechnen, erhalten wir etwa 1,6. Dies bedeutet, dass Ammoniak 1,6-mal schneller als das Ethanol reisen, und Sie werden das Ammoniak riechen, bevor Sie das Parfüm riechen!
Gasteilchen sind ständig in Bewegung in zufälliger Reihenfolge und schnelle Bewegung, die sie verursacht diffundieren und effuse. Johnny war in der Lage, weil die Diffusion jenen Chocolate Chip Cookies zu riechen. der Cookie Geruch wurde mehr ausgebreitet. Der Ballon Johnny hielt sich wegen Erguss kleiner. das Helium im Ballon entkam durch kleine Löcher in den Wänden des Ballons. Grahams Gesetz der Erguss bezieht sich die Preise der Erguss mit der Masse des Stoffes. So wird, wenn zwei Gase vergleichen, die relativen Geschwindigkeiten der Effusion oder Diffusion sind umgekehrt proportional zu den Quadratwurzeln ihrer Massen.
Lernerfolge
Nach dieser Lektion werden Sie in der Lage sein:
- Definieren Diffusion und Erguss
- Erklären Graham Gesetz
- Lösen der Praxis Probleme Graham Gesetz mit
Earning College-Kredit
Wussten Sie schon ... Wir haben mehr als 95 College-Kurse, die Sie Kredit von Prüfung zu verdienen vorbereiten, die von mehr als 2.000 Hochschulen und Universitäten akzeptiert wird. Sie können aus den ersten zwei Jahren College testen und Tausende von Ihrem Grad sparen. Jeder kann Kredit-by-Prüfung unabhängig von Alter oder Bildungsniveau verdient.
Übertragen von Kredit an die Schule Ihrer Wahl
Nicht sicher, welche Hochschule Sie noch teilnehmen möchten? Study.com hat Tausende von Artikeln über jeden erdenklichen Grad, Studienbereich und Karriereweg, dass Sie die Schule helfen können, finden die für Sie richtig ist.
Research Schools, Grad - Karriere
Holen Sie sich die unvoreingenommenen Informationen, die Sie die richtige Schule finden müssen.