Einzelaustauschreaktion - Definition, vorgehen und Beispiele, Chemie @
Es gibt kontinuierlichen Austausch jeden Tag um uns herum. Ebenso gibt es Ersatz auch in unseren chemischen Reaktionen auftreten. Diese Reaktionen werden als Ersatz rea ctions genannt. Wenn nur eine Substanz, die durch die andere ersetzt wird, werden die Reaktionen als einzelne Ersatzreaktionen bezeichnet.
Der Austausch in der Regel passieren, wenn der Ersatz mehr Stabilität und Festigkeit hat. In gleicher Weise ersetzt die Elemente mit höheren Reaktivität Elementen mit niedriger Reaktivität. Es gibt eine Reihe von einzelnen Ersatzreaktionen auftreten, um uns aus der Industrie zu chemischen Laboratorien.
Einzelaustauschreaktion Definition
Einzelaustauschreaktion ist eine Art der Reaktion, bei der einer der Reaktanten des Ions in der anderen Reaktanten ersetzt. Es ist eine chemische Reaktion, bei der ein Element oder Ion-Ion ersetzt ist, oder ein Element in Verbindung. Die allgemeine Darstellung der Austauschreaktion ist
A + BC $ \ rightarrow $ AB + C
Wobei A ein Ion oder Element und BC ist Verbindung Komponieren von Element B und C. Wenn die Verdrängungsreaktion Ionen- oder Element C auftritt, wird durch ein Element oder Ion ersetzt A.
Der Austausch kann nur geschehen, wenn das Austauschelement reaktiver als das eines ist, die ersetzt zu werden. Deshalb sind diese Reaktionen nicht rückgängig gemacht werden kann. Es ist auch einzelne displacemen t Reaktion genannt.
Einzelaustauschreaktion Beispiele
Es gibt verschiedene Beispiele für einzelne Austauschreaktion. Ein Beispiel aus der Stahlindustrie genommen werden, in denen Eisen aus Eisen (II) oxid-Lösung versetzt werden, unter Verwendung von Co ke (eine Form von Kohle). Die Reaktion wird wie folgt dargestellt:
Ein weiteres Beispiel aus der Statue der Freiheit genommen werden. Die Statue der Freiheit von innen besteht aus Eisen. Darüber wird es mit Kupfer beschichtet. Nach einiger Zeit ed das Kupfer auf dem oberen Anfang mit Luft reagieren, und ein bläulich-grüner Überzug wird auf dem Standbild gebildet. Die bläulich grüne Beschichtung beginnt in der Statue mit dem Eisen reagiert und einer einzigen Austauschreaktion stattfindet, in dem das Eisen zu Eisenoxid und außerhalb Kupfer oxidiert wird zurück ersetzt.
Es gibt weiter viele einzelnen Ersatz Reaktionen in oder chemischen Laboratorien und unser täglichen Leben auftreten.
Wenn Zink mit Salzsäure verbindet, ersetzt Zink Wasserstoff. Die chemische Reaktion kann dargestellt werden als
In ähnlicher Weise Eisen, Natrium und alle Elemente, die oben Wasserstoff können sie verdrängen und Wasserstoffgas herzustellen. Die Reaktionen sind als
Ein weiteres Beispiel aus Branchen Herstellung von Bauprodukten genommen werden. Kalk (Calcium), wenn sie mit Wasser vermischt erzeugt Calciumhydroxid unter Entwicklung von Wasserstoffgas.
Wie Einzel Ersatz Reaktionen zu tun?
Einzelaustauschreaktion tritt auf, wenn ein Element ein anderes Element in der Verbindung ersetzt. Dieser Austausch findet statt, wenn mehr reaktives Element das weniger reaktive Element ersetzt. Ein weniger reaktives Metall durch reaktives Metall ersetzt und ein weniger Nichtmetall durch reaktives Nichtmetall in Einzelaustauschreaktion ersetzt.
Wie können wir wissen über die Reaktivität eines Elements?
Es ist die Tätigkeit Serie, die uns über die Reaktivität eines Elements erzählt. Aktivität ist die Fähigkeit eines Elements mit anderem Elemente zu reagieren. Je höher die Aktivität reaktiver ist das Element. In der Aktivitätsreihe sind die Elemente entsprechend ihre Aktivitäten angeordnet ist. Die Elemente mit höherer Aktivität oder höherer Reaktivität sind auf der Oberseite der Tätigkeitsabfolge während diejenigen, die weniger reaktiv liegen unterhalb.
Unten ist die Aktivität Serie.
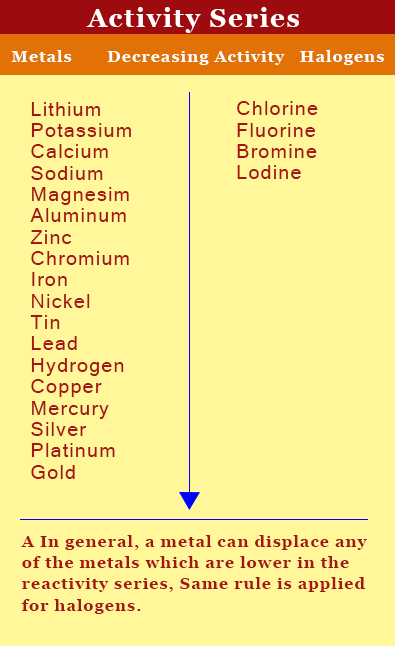
Das Metall kann jedes oben liegende Metall unten liegende ersetzen. Aber das Metall unter liegend können die Metalle nicht ersetzen darüber in der Tätigkeit Serie liegen. Zum Beispiel Lithium, die auf der Oberseite der Tätigkeit Serie können alle Metalle darunter ersetzen. In ähnlicher Weise für Nichtmetalle wie Halogene der nichtmetallischen oben liegenden kann eine beliebige nichtmetallischen unten liegenden ersetzen. Zum Beispiel ist Fluorine reaktiver als Chlor, Brom und Jod. Daher kann Fluorine leicht Chlor, Brom oder Jod ersetzen.
Auf diese Weise kann das Auftreten der Reaktion vorhergesagt werden. Wenn das Element, das das andere Element eine höhere Aktivität Serie ersetzt, wird die Reaktion stattfinden, wenn sie unterhalb der Reaktion nicht auftreten.
Zum Beispiel: bei der Reaktion zwischen Kupfer und Silbernitrat, Silbermetall und einer Lösung von blauem Kupfernitrat hergestellt. Die Reaktion trat auf, da Kupfer reaktiver ist als Silber. Die Reaktion wird wie folgt dargestellt:
Ein anderes Beispiel kann sein, Eisen mit Kupfernitrat umgesetzt wird, da Eisen reaktiver als Kupfer ist, er Reaktion auftritt und coper wird durch Eisen ersetzt.
Aber eine Reaktion zwischen Kupfer und Eisen (II) Nitrat wird auftreten, nicht als Kupfer kann Eisen aus Eisen (II) Nitratlösung nicht ersetzen.
Auf die gleiche Art und Weise, Halogene, die mehr reaktiv sind, können die Halogene ersetzen, die weniger reaktiv sind. Wenn beispielsweise Chlorgas durch Natriumbromidlösung geben wird, wird Natriumchlorid hergestellt. Dies ist auf mehrere Reaktivität von Chlor als Brom.